
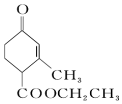
 和
和  ,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;
,前者不含氧的官能团为(写结构简式)羰基、酯基,后者官能团有(写名称)酯基、羟基;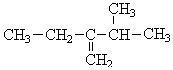 的名称为3-甲基-2-乙基-1-丁烯,
的名称为3-甲基-2-乙基-1-丁烯,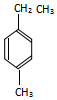 的名称为对甲基乙苯;
的名称为对甲基乙苯;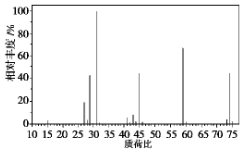
分析 (1)常见含有官能团有羟基、醛基、酯基、羰基等,结合有机物 和
和  的结构简式分析;
的结构简式分析;
(2)根据烷烃通式确定该烷烃中碳原子个数,烷烃的同分异构体中,支链越多,其沸点越低;
(3)
(4)A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,说明H原子相同,应为3个甲基连接在同一个C原子上;
(5)据质谱图可知,该有机物的相对分子质量为74,若该有机物含有一个氧原子,剩余式量为74-16=58,据此判断其分子式.
解答 解:(1) 中含有含氧官能团为:羰基、酯基;
中含有含氧官能团为:羰基、酯基; 中含有的含氧官能团为:酯基、羟基,
中含有的含氧官能团为:酯基、羟基,
故答案为:羰基、酯基;酯基、羟基;
(2)设该烷烃中碳原子个数是n,通式为CnH2n+2,14n+2=72,n=5,所以该烷烃是戊烷,烷烃的同分异构体中,支链越多,其沸点越低,所以相对分子质量为72且沸点最低的烷烃的结构简式C(CH3)4,
故答案为:C(CH3)4;
(3)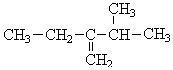 为烯烃,碳碳双键在1号C,含有碳碳双键的最长碳链含有4个C,主链为丁烯,在2号C含有1个乙基、在3号C含有1个甲基,该有机物名称为:3-甲基-2-乙基-1-丁烯;
为烯烃,碳碳双键在1号C,含有碳碳双键的最长碳链含有4个C,主链为丁烯,在2号C含有1个乙基、在3号C含有1个甲基,该有机物名称为:3-甲基-2-乙基-1-丁烯; 中甲基和乙基在苯环的对位C上,其主链为乙苯,该有机物名称为:对甲基乙苯,
中甲基和乙基在苯环的对位C上,其主链为乙苯,该有机物名称为:对甲基乙苯,
故答案为:3-甲基-2-乙基-1-丁烯;对甲基乙苯;
(4)A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则A为(CH3)3CCl,
故答案为:(CH3)3CCl;
(5)根据质谱图可知,该有机物的相对分子质量为74,若该有机物含有一个氧原子,则剩余式量为74-16=58,分子式可能为C4H10O,
故答案为:C4H10O.
点评 本题考查较为综合,涉及有机物分子式确定、有机物命名、官能团判断等知识,题目难度中等,明确常见有机物组成、结构与性质为解答关键,注意掌握有机物的命名原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | ②③⑦ | B. | ①④⑥ | C. | ②③⑥ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
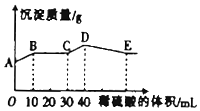 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )| A. | AB段发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ | |
| B. | E点对应横坐标稀硫酸的体积为70mL | |
| C. | D点表示的沉淀的化学式为Al(OH)3、BaSO4 | |
| D. | E点沉淀比A点沉淀质量大2.33g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物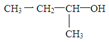 的名称为2-丁醇 的名称为2-丁醇 | |
| B. | 蛋白质、淀粉、纤维素都是高分子化合物 | |
| C. | 合成有机物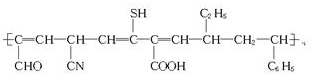 使用的单体有3种 使用的单体有3种 | |
| D. | 等质量的乙烯和乙醇完全燃烧消耗氧气的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
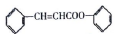 是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示: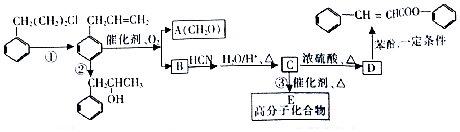
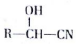 $→_{△}^{H_{2}O/H+}$
$→_{△}^{H_{2}O/H+}$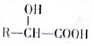
 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +nH2O.
+nH2O. (任写一种).
(任写一种). )的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物)
)的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
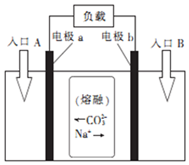 “直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能.用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图.下列有关说法正确的是( )
“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能.用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图.下列有关说法正确的是( )| A. | 该电池的总反应为C+O2═CO2 | |
| B. | 煤直接燃烧发电比直接煤燃料电池发电的能量利用率高 | |
| C. | 进入反应室的煤块粉碎成粉末状对反应速率和限度均无影响 | |
| D. | 电子由电极b沿导线流向电极a,入口A加入的物质为煤粉 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com