
 £¬ŌŚ¼ÓČČ”¢“߻ƼĮĢõ¼žĻĀ£¬°±ĘųŗĶŃõĘų·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĖ®ŗĶŅ»Ńõ»ÆµŖ£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ4NH3+5O2
£¬ŌŚ¼ÓČČ”¢“߻ƼĮĢõ¼žĻĀ£¬°±ĘųŗĶŃõĘų·¢ÉśŃõ»Æ»¹Ō·“Ӧɜ³ÉĖ®ŗĶŅ»Ńõ»ÆµŖ£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ4NH3+5O2 4NO+6H2O£¬
4NO+6H2O£¬ £»4NH3+5O2
£»4NH3+5O2 4NO+6H2O£¬
4NO+6H2O£¬


| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ





²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ


| ||
| ”÷ |
| ||
| ”÷ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012½ģɽĪ÷Ź”ɽ“óø½ÖŠøßČżµŚŅ»“ĪÄ£ÄāŹŌĢāĄķ×Ū»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
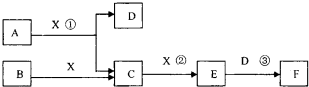
£Ø14·Ö£©ŅŃÖŖÓɶĢÖÜĘŚ³£¼ūŌŖĖŲŠĪ³ÉµÄ“æ¾»ĪļA”¢B”¢C”¢D”¢E”¢F”¢X×Ŗ»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾£¬B”¢XĪŖµ„ÖŹ£¬D³£ĪĀĻĀĪŖĪŽÉ«ŅŗĢ壬A”¢Bŗ¬Ķ¬Ņ»ÖÖŌŖĖŲ”££ØijŠ©²śĪļæÉÄÜĀŌČ„£©
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ČōEŹĒÓŠÉ«ĘųĢ壬FŹĒŅ»ŌŖĒæĖį£¬·“Ó¦¢ŁŹĒ¹¤ŅµÖʱøFµÄµŚŅ»²½·“Ó¦”£
¢ŁŠ“³öAÓėX·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ ”£
¢ŚÓŠČĖČĻĪŖ”°ÅØH2SO4æÉŅŌøÉŌļĘųĢåE”±”£Ä³Ķ¬Ń§ĪŖĮĖŃéÖ¤øĆ¹ŪµćŹĒ·ńÕżČ·£¬ÓĆĻĀĶ¼×°ÖĆ½ųŠŠŹµŃ锣ŹµŃé¹ż³ĢÖŠ£¬ÅØH2SO4ÖŠĪ“·¢ĻÖÓŠĘųĢåŅŻ³ö£¬ĒŅÅØH2SO4ÓÉĪŽÉ«±äĪŖŗģ×ŲÉ«£¬ÓÉ“ĖÄćµĆ³öµÄ½įĀŪŹĒ ”£
¢ŪŅŃÖŖ³£ĪĀĻĀ1 molĘųĢåE·¢Éś·“Ó¦¢Ū·Å³ö46kJČČĮ棬Š“³öĘųĢåEÓėH2O·“Ó¦µÄČČ»Æѧ·½Ź½ ”£
¢ÜŌŚ³£ĪĀĻĀ£¬ĻņV1L pH=aµÄAČÜŅŗÖŠ¼ÓČėV2L pH=bµÄŃĪĖį£¬ĒŅa+b=14£¬Čō·“Ó¦ŗóČÜŅŗµÄpH<7£¬ŌņV1ŗĶV2µÄ¹ŲĻµĪŖV1 V2£ØĢī>”¢<”¢ĪŽ·ØČ·¶Ø£©£¬ĖłµĆČÜŅŗÖŠø÷ÖÖĄė×ÓµÄÅضČÓɓ󵽊”µÄĖ³ŠņæÉÄÜŹĒ ”££ØŠ“³öŅ»ÖÖĒéæö¼“æÉ£©
£Ø2£©ČōEĪŖĪŽÉ«ĪŽĪ¶ĘųĢ壬FŹĒ¶žŌŖČõĖį”£
¢ŁEµÄµē×ÓŹ½ĪŖ £»
¢Ś½«ÉŁĮæĘųĢåEĶØČėĒāŃõ»Æ±µČÜŅŗÖŠµĆ²»ČÜĪļG£¬GµÄKSP=8.1”Į10-9”£ĻÖ½«øĆ³Įµķ·ÅČė0.1mol/LµÄBaCl2ČÜŅŗÖŠ£¬ĘäKSP £¬£ØĢī£ŗŌö“󔢼õŠ”»ņ²»±ä£©£¬“ĖŹ±£¬×é³É²»ČÜĪļGµÄŅõĄė×ÓŌŚČÜŅŗÖŠµÄÅضČĪŖ mol/L”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2011-2012Ń§ÄźÉ½Ī÷Ź”øßČżµŚŅ»“ĪÄ£ÄāŹŌĢāĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĶʶĻĢā
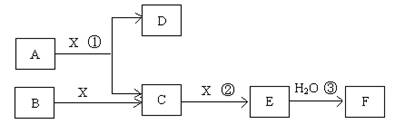
£Ø14·Ö£©ŅŃÖŖÓɶĢÖÜĘŚ³£¼ūŌŖĖŲŠĪ³ÉµÄ“æ¾»ĪļA”¢B”¢C”¢D”¢E”¢F”¢X×Ŗ»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾£¬B”¢XĪŖµ„ÖŹ£¬D³£ĪĀĻĀĪŖĪŽÉ«ŅŗĢ壬A”¢Bŗ¬Ķ¬Ņ»ÖÖŌŖĖŲ”££ØijŠ©²śĪļæÉÄÜĀŌČ„£©
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ČōEŹĒÓŠÉ«ĘųĢ壬FŹĒŅ»ŌŖĒæĖį£¬·“Ó¦¢ŁŹĒ¹¤ŅµÖʱøFµÄµŚŅ»²½·“Ó¦”£
¢ŁŠ“³öAÓėX·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ ”£
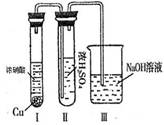
¢ŚÓŠČĖČĻĪŖ”°ÅØH2SO4æÉŅŌøÉŌļĘųĢåE”±”£Ä³Ķ¬Ń§ĪŖĮĖŃéÖ¤øĆ¹ŪµćŹĒ·ńÕżČ·£¬ÓĆĻĀĶ¼×°ÖĆ½ųŠŠŹµŃ锣ŹµŃé¹ż³ĢÖŠ£¬ÅØH2SO4ÖŠĪ“·¢ĻÖÓŠĘųĢåŅŻ³ö£¬ĒŅÅØH2SO4ÓÉĪŽÉ«±äĪŖŗģ×ŲÉ«£¬ÓÉ“ĖÄćµĆ³öµÄ½įĀŪŹĒ ”£
¢ŪŅŃÖŖ³£ĪĀĻĀ1 molĘųĢåE·¢Éś·“Ó¦¢Ū·Å³ö46kJČČĮ棬Š“³öĘųĢåEÓėH2O·“Ó¦µÄČČ»Æѧ·½Ź½ ”£
¢ÜŌŚ³£ĪĀĻĀ£¬ĻņV1L pH=aµÄAČÜŅŗÖŠ¼ÓČėV2L pH=bµÄŃĪĖį£¬ĒŅa+b=14£¬Čō·“Ó¦ŗóČÜŅŗµÄpH<7£¬ŌņV1ŗĶV2µÄ¹ŲĻµĪŖV1 V2£ØĢī>”¢<”¢ĪŽ·ØČ·¶Ø£©£¬ĖłµĆČÜŅŗÖŠø÷ÖÖĄė×ÓµÄÅضČÓɓ󵽊”µÄĖ³ŠņæÉÄÜŹĒ ”££ØŠ“³öŅ»ÖÖĒéæö¼“æÉ£©
£Ø2£©ČōEĪŖĪŽÉ«ĪŽĪ¶ĘųĢ壬FŹĒ¶žŌŖČõĖį”£
¢ŁEµÄµē×ÓŹ½ĪŖ £»
¢Ś½«ÉŁĮæĘųĢåEĶØČėĒāŃõ»Æ±µČÜŅŗÖŠµĆ²»ČÜĪļG£¬GµÄKSP=8.1”Į10-9”£ĻÖ½«øĆ³Įµķ·ÅČė0.1mol/LµÄBaCl2ČÜŅŗÖŠ£¬ĘäKSP £¬£ØĢī£ŗŌö“󔢼õŠ”»ņ²»±ä£©£¬“ĖŹ±£¬×é³É²»ČÜĪļGµÄŅõĄė×ÓŌŚČÜŅŗÖŠµÄÅضČĪŖ mol/L”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com