
| X | Y | |
| Z | W |
| A. | 元素X和元素W最高正价代数和一定为8 | |
| B. | 若元素X的原子序数为a,则Z的原子序数一定为a+9. | |
| C. | 常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 | |
| D. | 原子半径的大小顺序为rW>rZ>rX>rY. |
分析 前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示,
如果X是C元素,则Y、Z、W分别是N、P、S元素;
如果X是N元素,则Y、Z、W分别是O、S、Cl元素;
如果X是Si元素,则Y、Z、W分别是P、As、Se元素;
如果X是P元素,则Y、Z、W分别是S、Se、Br元素;
即如果X位于第IVA族,则Y和Z位于第VA族、W位于第VIA族;
如果X位于第VA族,则Y和Z位于第VIA族、W位于第VIIA族;
A.主族元素最高正化合价与其族序数相等,但O、F元素除外;
B.若X的原子序数是a,Z的原子序数可能是a+9或a+19;
C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则X是N元素,Y为O元素,含有氢键的氢化物熔沸点较高;
D.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小.
解答 解:前四周期主族非金属元素X、Y、Z和W在元素周期表中的相应位置如图所示,
如果X是C元素,则Y、Z、W分别是N、P、S元素;
如果X是N元素,则Y、Z、W分别是O、S、Cl元素;
如果X是Si元素,则Y、Z、W分别是P、As、Se元素;
如果X是P元素,则Y、Z、W分别是S、Se、Br元素;
即如果X位于第IVA族,则Y和Z位于第VA族、W位于第VIA族;
如果X位于第VA族,则Y和Z位于第VIA族、W位于第VIIA族;
A.主族元素最高正化合价与其族序数相等,但O、F元素除外,如果X位于第IVA族,则W位于第VIA族,元素X和元素W最高正价代数和为10,如果X位于第VA族、W位于第VIIA族,则元素X和元素W最高正价代数和为12,故A错误;
B.若X的原子序数是a,Z的原子序数可能是a+9或a+19,故B错误;
C.常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则X是N元素,Y为O元素,含有氢键的氢化物熔沸点较高,只有水中含有氢键,所以其熔沸点高于W的氢化物,故C正确;
D.原子电子层数越多,其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径rz>rw>rX>rY,故D错误;
故选C.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,明确元素周期表结构及物质结构和性质是解本题关键,注意规律中的反常现象,注意:氢化物的稳定性与化学键有关,氢化物的熔沸点与分子间作用力和氢键有关,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 将NaHCO3固体加入新制的氯水中,有无色气泡(H+) | |
| B. | 向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,发现呈红色(Cl2) | |
| C. | 将FeCl2溶液滴到氨水中生成的白色沉淀很快变色(O2) | |
| D. | 将FeCl3溶液滴到淀粉-KI试纸上,试纸变蓝(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 结果 加入物质 变量 | H2O | NH4Cl(s) | NaOH(s) | 浓盐酸 |
| (1)c(NH3•H20) | ||||
| (2)n(OH-) | ||||
| (3)c(OH-) | ||||
| (4)电离平衡移动方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:
实验室某浓硫酸试剂瓶上的标签如表所示,试根据标签上的有关数据回答下列问题:| 硫酸 化学式 H2SO4 相对分子质量98 密度 1.84g/cm3 质量分数98% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
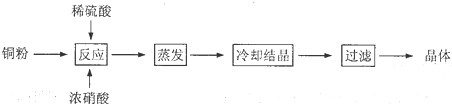
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol N2中含有的电子数为2NA | |
| B. | 标准状态下,1mol水所含的氧原子数为1NA | |
| C. | 常温常压下,17g氨气所含的分子数大于NA | |
| D. | 2g氢气所含的氢原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量生产、使用能过滤PM2.5的口罩 | |
| B. | 开发利用太阳能、氢能、风能等清洁能源 | |
| C. | 用石灰对煤燃烧后形成的烟气进行脱硫处理 | |
| D. | 研发廉价、高效的催化剂,以降低汽车尾气中有害物质的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com