
分析 乙烯和水在一定条件下发生加成反应生成乙醇,乙醇发生催化氧化反应生成乙醛,乙醛被氧化生成乙酸,乙酸和乙醇在浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸乙酯.
解答 解:乙烯和水在一定条件下发生加成反应生成乙醇,乙醇发生催化氧化反应生成乙醛,乙醛被氧化生成乙酸,乙酸和乙醇在浓硫酸作催化剂、加热条件下发生酯化反应生成乙酸乙酯,反应方程式分别为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH、2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O、2CH3CHO+O2$\stackrel{一定条件下}{→}$2CH3COOH、CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;2CH3CHO+O2$\stackrel{一定条件下}{→}$2CH3COOH;CH3COOH+CH3CH2OH $?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
点评 本题考查化学方程式的书写,为高频考点,书写时注意断键和成键方式及反应条件,条件不同可能导致产物不同,题目难度不大.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+Br2→BrCH2CH2Br | |
| B. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 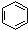 +HNO3$\stackrel{浓硫酸△}{→}$ +HNO3$\stackrel{浓硫酸△}{→}$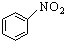 +H2O +H2O | |
| D. | C6H12O6$→_{△}^{催化剂}$2C2H5OH+2CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. ;CH2=CH2和
;CH2=CH2和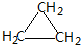 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
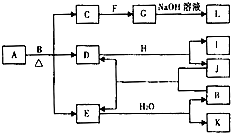 由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题:
由两种元素组成的化合物A存在如图所示的转化关系(部分产物及反应条件已略去).已知:E为红棕色气体,F、H为金属单质,J为黑色非金属单质.L露置于空气中时,由白色最终转化为红褐色,B与F反应时可生成C,也可生成G.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com