
| A. | 将58.5 g NaCl溶于1 L水中可得1 mol•L-1的NaCl溶液 | |
| B. | 从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L | |
| C. | 中和100 mL 1 mol/L的H2SO4溶液生成正盐,需NaOH 4 g | |
| D. | 将78 g Na2O2溶于水,配成1 L溶液可得到浓度为1 mol•L-1溶液 |
分析 A.物质的量浓度中,体积为溶液的体积不是溶剂的体积;
B.溶液具有均一性;
C.100 mL 1 mol/L的H2SO4溶液的物质的量为:0.1mol,要生成正盐消耗氢氧化钠0.2mol;
D.依据Na2O2~2NaOH,计算78g Na2O2溶于水生成的氢氧化钠的物质的量,依据C=$\frac{n}{V}$分析解答.
解答 解:A.将58.5g NaCl的物质的量为1mol,溶于1L水中,配成的溶液的体积大于1L,浓度小于1mol•L-1,故A错误;
B.溶液具有均一性,所以从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L,故B正确;
C.100 mL 1 mol/L的H2SO4溶液的物质的量为:0.1mol,要生成正盐消耗氢氧化钠0.2mol,质量为:8g,故C错误;
D.78g Na2O2溶于水反应生成2mol氢氧化钠,溶液的体积为1L,溶液的浓度为2mol/L,故D错误;
故选:B.
点评 本题考查一定物质的量浓度溶液的配制,难度不大,明确物质的量浓度定义是解题关键,注意体积为溶液的体积.


科目:高中化学 来源: 题型:选择题
| A. | 可以利用丁达尔效应区别胶体和溶液 | |
| B. | 往醋酸溶液中通入足量氨气溶液导电能力变强 | |
| C. | 往FeCl3饱和溶液中逐滴加入浓NaOH溶液边滴加边振荡,可以制得Fe(OH)3胶体 | |
| D. | 丙烯醛(结构简式为CH2═CH-CHO)在一定条件下与H2充分反应生成1-丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
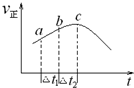 (1)NO2与SO2混合可发生反应:SO2(g)+NO2(g)═SO3(g)+NO(g);①将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示.由图可知下列说法正确的是C(填字母).
(1)NO2与SO2混合可发生反应:SO2(g)+NO2(g)═SO3(g)+NO(g);①将一定量的NO2与SO2置于绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的趋势如图所示.由图可知下列说法正确的是C(填字母).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL,1mol•L-1 的NaCl | B. | 100mL,2mol•L-1 的MgCl2 | ||
| C. | 100mL,1mol•L-1 的FeCl3 | D. | 50mL,3mol•L-1 的FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg碳-12含有约6.02×1023个碳原子 | |
| C. | 阿伏伽德罗常数的数值约等于6.02×1023 | |
| D. | 使用摩尔时必须指明微粒的名称 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
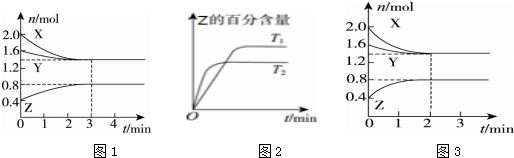
| A. | 容器中发生的反应可表示为3X(g)+Y(g)═2Z(g) | |
| B. | 反应进行的前3 min内,用X表示的反应速率v(X)=0.2 mol/(L•min) | |
| C. | 保持其他条件不变,升高温度,反应的化学平衡常数K减小 | |
| D. | 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(W)=v(Z) | B. | 2v(X)=3v(Z) | C. | v(X)=2v(Y) | D. | 3v(W)=2v(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
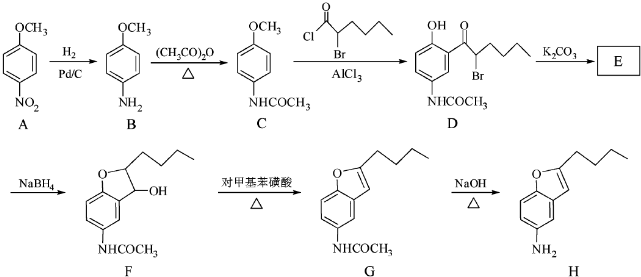
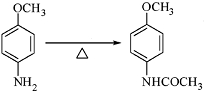 +CH3COOH
+CH3COOH .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾中铁显+3价 | |
| B. | 湿法中每生成1mol Na2FeO4转移3 mol电子 | |
| C. | 干法中每生成1mol Na2FeO4转移4 mol电子 | |
| D. | K2FeO4处理水时,不仅能消毒杀菌,还能吸附水中的悬浮杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com