
| A. | C原子采取sp3杂化,O原子采取sp杂化 | |
| B. | 甲醛分子中中心原子价层电子对数为4,含有一对孤电子对,是三角锥形结构 | |
| C. | 甲醛分子与水分子间可以形成氢键 | |
| D. | 甲醛分子为非极性分子 |
分析 A.根据杂化轨道理论分析,杂化轨道用于成σ键和填充孤电子对;
B.甲醛分子中心原子为C原子,价层电子对数等于σ键+孤电子对;
C.氧元素电负性很大,水分子中H原子几乎是裸露的质子,甲醛分子与水分子间可以形成氢键;
D.甲醛分子是平面三角形,碳原子位于三角形内部,结构不对称.
解答 解:A.HCHO中C原子成2个C-H键、1个C=O双键,杂化轨道数为3,C原子采取sp2杂化,O原子成1个C=O双键,含有2对孤电子对,杂化轨道数为3,O原子采取sp2杂化,故A错误;
B.甲醛分子中成2个C-H键、1个C=O双键,价层电子对数为2+1=3,不含孤电子对,为平面三角形,故B错误;
C.氧元素电负性很大,水分子中H原子几乎是裸露的质子,甲醛分子中O原子与水分子中H原子之间可以形成氢键,故C正确;
D.甲醛分子是平面三角形,碳原子位于三角形内部,结构不对称,所以极性分子,故D错误.
故选C.
点评 本题考查杂化轨道、价层电子对互斥理论、氢键、分子极性等,难度中等,注意理解杂化轨道理论与价层电子对互斥理论,进行分子构型的判断.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
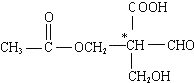 含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )
含有一个手性碳原子,具有光学活性,当发生下列化学变化,生成的新有机物仍有光学活性的是( )| A. | 与NaOH溶液共热 | B. | 与银氨溶液共热 | ||
| C. | 与金属钠反应 | D. | 与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为p轨道是“8”字形的,所以p电子走“8”字形 | |
| B. | 第三电子层,有3s、3p、3d三个轨道 | |
| C. | 在一个基态多电子的原子中,不可能有两个能量完全相同的电子 | |
| D. | 一般情况下,σ键比π键重叠程度大,形成的共价键强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同素异形体 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se物理性质和化学性质均相同 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se都含有34个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A2)=0.8 mol•L-1•s-1 | B. | v(A2)=30 mol•L-1•min-1 | ||
| C. | v(AB3)=1.0 mol•L-1•s-1 | D. | v(B2)=1.2 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3BO3的酸性比H2CO3的强 | |
| B. | Mg(OH)2的碱性比Be(OH)2的强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | 若M+和R2-的核外电子层结构相同,则原子序数:R>M |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.
合成氨是化学科学对人类社会发展与进步作出巨大贡献的典例之一,合成氨工业包括原料气的制备、净化、氨的合成及各种化肥生产等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 10%H2O2的体积/mL | 5.0 | 5.0 | V1 | V2 |
| 20%硫酸的体积/mL | 0 | 0.5 | 1.0 | V3 |
| 水的体积/mL | 15 | 14.5 | V4 | 13.5 |
| 所需时间t/s | t1 | t2 | t3 | t4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com