
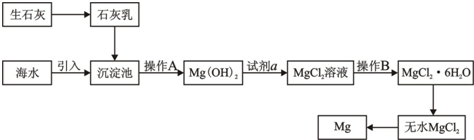
海水提镁的工业流程
贝壳在生产流程中起什么作用?其主要成分发生了怎样的化学变化?
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:设计必修一化学鲁科版 鲁科版 题型:022
镁和海水提镁
1.海水中镁的含量
总储量:1.28 g·L-1,世界上有60%镁来自于海水.
2.海水提镁的工业流程
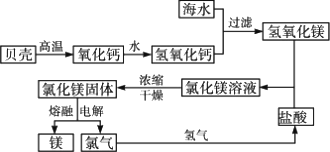
讨论:贝壳在生产流程中起提供Mg2+沉淀剂的作用.其主要成分发生了分解反应:
CaCO3![]() CaO+CO2↑
CaO+CO2↑
3.镁的性质和用途
(1)镁的主要物理性质:密度________、强度________、机械性能好的银白色金属.
(2)镁的化学性质
①与非金属单质反应
2Mg+O2![]() ________
________
Mg+Cl2![]() ________
________
3Mg+N2![]() ________
________
②与CO2反应
2Mg+CO2![]() ________
________
③与酸反应
2Mg+2HCl![]() ________
________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com