
【题目】常温常压下,下列各组气体不能共存的是( )
A. SO2与O2 B. NO2与NO
C. O2与N2 D. NO与O2
 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验验证反应得到的混合气体中含有SO2、H2、H2O
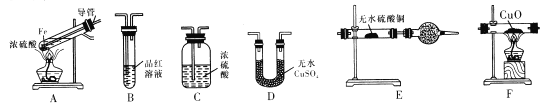
已知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________。
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→______(不可重复使用)。
(3)A中导管的作用为_____,装置E中的干燥管中盛放的物质为碱石灰,其作用是_______。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:
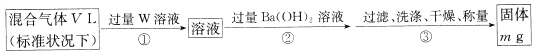
(5) W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为_____________(用含V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的电池,总反应为: 3Zn+2FeO42-+8H2O=2Fe(OH)3↓+3Zn(OH)2↓+4OH—,其工作原理如图所示。下列说法不正确的是
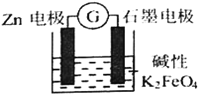
A. Zn极是负极,发生氧化反应
B. 随着反应的进行,溶液的pH增大
C. 电子由Zn极流出到石墨电极,再经过溶液回到Zn极,形成回路
D. 石墨电极上发生的反应为:FeO42—+3e—+4H2O=Fe(OH)3↓+5OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中烧杯里盛的是天然水,铁被腐蚀由快到慢的顺序是( )
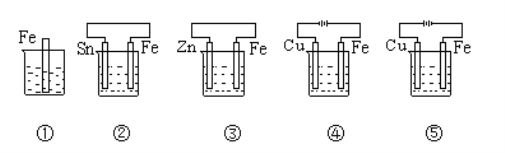
铁被腐蚀由快到慢的顺序是
A. ③〉②〉①〉④〉⑤ B. ④〉②〉①〉③〉⑤
C. ③〉②〉④〉⑤〉① D. ④〉⑤〉②〉③〉①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学平衡常数K的说法中,正确的是
A. K的大小与起始浓度有关
B. 温度越高,K值越大
C. K值越大,反应正向进行的程度越大
D. K值越大,反应正向进行的程度越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )

A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:K+、Na+、MnO4-、SO42-
B.使无色酚酞试液显红色的溶液:S2-、K+、HCO3-、Na+
C.酸性溶液中:Na+、Fe3+、SO42-、Cl-
D.0.1mol/L 的 FeCl3溶液中:Na+、H+、SCN-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
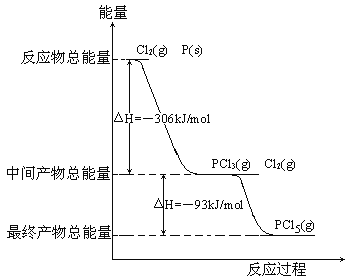
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式_________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式_________________________________,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于_________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2_______α1(填“大于”、“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是________________________________________。
(4)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应:aX(g)+bY(g)![]() cZ(g)达到平衡时测得平衡常数为K1;保持温度不 变,将容器体积减小一半,当达到新平衡后,测得Y的浓度为原来的1.6倍,平衡常数为K2,则
cZ(g)达到平衡时测得平衡常数为K1;保持温度不 变,将容器体积减小一半,当达到新平衡后,测得Y的浓度为原来的1.6倍,平衡常数为K2,则
A. 平衡向正反应方向移动,K2>K1
B. 新平衡时Y的浓度增大,平衡向逆反应方向移动K1>K2
C. 新平衡时,Z的浓度大于原平衡2倍,K1=K2
D. 反应过程中,化学反应速率同等程度增大,K1=K2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com