
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
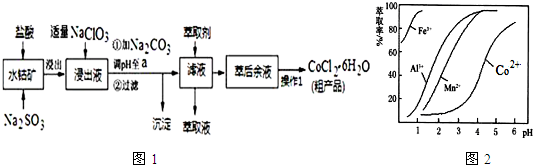
分析 含钴废料中加入盐酸,加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl2•6H2O晶体,应控制温度在86℃以下,加热时要防止温度过高而失去结晶水,可减压烘干,
(1)亚硫酸钠具有还原性,能还原氧化性离子;
(2)NaClO3的作用是将Fe2+氧化成Fe3+;在酸性条件下,NaClO3与氯离子发生氧化还原反应生成氯气;
(3)根据铝离子、铁离子能与碳酸根离子发生双水解生成沉淀和二氧化碳进行解答;
(4)根据从溶液中制取固体的方法制取氯化钴固体,从而确定操作步骤;温度高时,CoCl2•6H2O分解;
(5)由表中数据可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(6)根据AgCl沉淀质量为4.6g,可计算得粗产品中CoCl2•6H2O的质量,据此计算粗产品中CoCl2•6H2O的质量分数;
解答 解:(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,
故答案为:将Fe3+、Co3+还原;
(2)NaClO3的作用是将Fe2+氧化成Fe3+,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;在酸性条件下,NaClO3与氯离子发生氧化还原反应生成氯气,其反应的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(3)NaClO3的作用是将Fe2+氧化成Fe3+,加Na2CO3调pH至a,为使铝离子沉淀完全,而钴离子不沉淀,根据表中数据可知pH值的范围是5.2≤a≤7.6,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,所以沉淀成分为:Fe(OH)3、Al(OH)3,
故答案为:5.2≤a≤7.6;Fe(OH)3、Al(OH)3;
(4)利用从溶液中制取固体的方法制取氯化钴固体,其操作步骤为:蒸发浓缩、冷却结晶和过滤;
根据题意知,CoCl2•6H2O常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴,为防止其分解,制得的CoCl2•6H2O需减压烘干,
故答案为:蒸发浓缩;冷却结晶;降低烘干温度,防止产品分解;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;
由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:除去溶液中的Mn2+;B;
(6)根据AgCl沉淀质量为4.6g,可计算得粗产品中CoCl2•6H2O的质量为$\frac{4.6}{143.5}×\frac{1}{2}×(59+71+108)$g×$\frac{100}{25}$=15.26g,所以粗产品中CoCl2•6H2O的质量分数为$\frac{15.26g}{16.4g}$×100%=93.0%,
故答案为:93.0%.
点评 本题通过制取CoCl2•6H2O的工艺流程,考查了物质制备方案的设计,题目难度中等,理解工艺流程图、明确实验操作与设计及相关物质的性质是解答本题的关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到平衡时,N2和H2的转化率之比为1:1 | |
| B. | 10分钟内v(H2)=0.35mol/(L•min) | |
| C. | 平衡混合气体的密度为124g/L | |
| D. | 平衡混合气体中,n(N2):n(H2):n(NH3)=1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是铝合金 | |
| B. | 84消毒液在日常生活中使用广泛,溶液无色、有漂白作用,它的有效成分为Ca(ClO)2 | |
| C. | 碳酸钠俗名纯碱,也叫苏打,可用于清洗厨房用具的油污 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | ① | B. | ②④ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的NaClO 溶液中含有ClO-的数目小于NA | |
| B. | 标准状况下,22.4LCCl4中含有个NACCl4分子 | |
| C. | 常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 足量的H2O2溶液与1molFe2+反应,转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 价格/元?吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的化学方程式是A+3B═2C | |
| B. | 该反应的正反应为放热反应 | |
| C. | 定容条件下,混合气体的密度不再变化,则证明该反应达到平衡 | |
| D. | 压强增大,则该反应的正反应速率增大,逆反应速率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com