
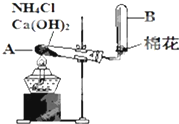
 如图是实验室用氯化铵和熟石灰制取氨气的实验装置图.请回答以下各问题:
如图是实验室用氯化铵和熟石灰制取氨气的实验装置图.请回答以下各问题:分析 (1)实验室制备氨气的方法是利用固体氯化铵和氢氧化钙加热反应生成氨气;
(2)固体在大试管中加热会生成水,试管A的管口必须稍向下倾斜,防止水倒流;
(3)氨气是极易溶于水的气体,收集时试管必须干燥;
(4)氨气能使湿润的红色石蕊试纸变蓝色进行验证.
解答 解:(1)实验室制备氨气的方法是利用固体氯化铵和氢氧化钙加热反应生成氨气,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)试管A的管口必须稍向下倾斜,其作用是防止反应过程中生成的水倒流回试管炸裂试管,
故答案为:防止反应过程中生成的水倒流回试管炸裂试管;
(3)氨气是极易溶于水的气体,收集时试管必须干燥,否则收集不到氨气,
故答案为:氨气是极易溶于水的气体;
(4)检验氨气已充满试管B的方法是用湿润的红色石蕊试纸靠近B试管口,试纸变蓝证明集满,
故答案为:用湿润的红色石蕊试纸靠近B试管口,试纸变蓝证明集满.
点评 本题考查了实验室制备氨气的实验过程分析,实验基本操作和物质性质是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 吃馒头时,多咀嚼后有甜味 | |
| B. | 淀粉溶液和稀硫酸共热一段时间后,滴加碘水不显蓝色 | |
| C. | 乙烯与水在一定条件下反应生成乙醇 | |
| D. | 油脂与氢氧化钠溶液共煮后可以得到肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸并加热 | |
| B. | KNO3溶液(AgNO3):加过量KCl溶液,过滤 | |
| C. | NaCl溶液(Br2):加CCl4,分液 | |
| D. | NaCl溶液(KNO3):加热蒸发得浓溶液后,降温,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中通入乙烯气体后,颜色会褪去 | |
| B. | 一定条件下,溴水可与氢气发生加成反应 | |
| C. | 乙烯可令酸性高锰酸钾溶液褪色 | |
| D. | 乙烯可燃,完全燃烧后产生CO2和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | 0.1 mol•L-1的硫化钠溶液中,c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com