
| 沉淀物 | Fe(OH)3 | Al(OH3) | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
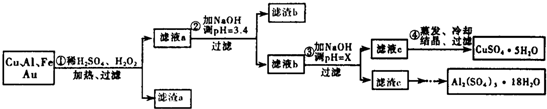
分析 由流程可知,金属混合物加入稀硫酸铝、铁溶解,加入过氧化氢,亚铁离子被氧化为铁离子,铜在酸性溶液中被过氧化氢氧化为铜离子,过滤得到滤渣a为Au,滤液中主要含有铁离子铝离子和铜离子,加入氢氧化钠溶液调节溶液PH=3.4,依据题干信息,是为了沉淀铁离子,过滤得到滤渣b为Fe(OH)3,滤液为铝离子和铜离子,加入氢氧化钠溶液调节溶液PH=5.2-5.4使铝离子全部沉淀过滤得到滤渣C为Al(OH)3,用硫酸溶解后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体;得到滤液为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体,
(1)过滤操作用到的仪器有烧杯、漏斗、玻璃棒;
(2)铜被双氧水氧化成铜离子,据此写出反应的离子方程式;
(3)Cu、Al及少量Fe、Au等金属的混合物,其中铜、铝、铁都发生反应而溶解,Au化学性质稳定,成为滤渣a的主要成分;
(4)滤渣c是氢氧化铝,根据部分阳离子以氢氧化物形式沉淀时溶液的pH表,选择使氢氧化铝沉淀完全且氢氧化铜不沉淀的PH;
(5)①依据滴定实验发生的反应的定量关系进行计算样品中所含铜离子物质的量,结合元素守恒计算硫酸铜 晶体质量分数;
②样品中含有硫酸钠,测定硫酸根离子含量不能计算得到硫酸铜晶体的含量;
(6)滤渣C主要是氢氧铝,加入硫酸溶解后通过这蒸发浓缩,冷却结晶,过滤洗涤得到晶体Al2(SO4)3•18H2O.
解答 解:由流程可知,金属混合物加入稀硫酸铝、铁溶解,加入过氧化氢,亚铁离子被氧化为铁离子,铜在酸性溶液中被过氧化氢氧化为铜离子,过滤得到滤渣a为Au,滤液中主要含有铁离子铝离子和铜离子,加入氢氧化钠溶液调节溶液PH=3.4,依据题干信息,是为了沉淀铁离子,过滤得到滤渣b为Fe(OH)3,滤液为铝离子和铜离子,加入氢氧化钠溶液调节溶液PH=5.2-5.4使铝离子全部沉淀过滤得到滤渣C为Al(OH)3,用硫酸溶解后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体;得到滤液为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(1)过滤是化学实验中经常用到的实验操作.过滤操作中用到的玻璃仪器有烧杯、玻璃棒、漏斗,故答案为:烧杯、漏斗、玻璃棒;
(2)Cu可溶于稀硫酸与H2O2的混合溶液,铜被氧化成铜离子,双氧水生成水,根据化合价升降相等配平,反应的离子方程式是Cu+H2O2+2H+═Cu2++2H2O,
故答案为:Cu+H2O2+2H+═Cu2++2H2O;
(3)由于Cu、Al、Fe都因反应溶解于溶液中,剩下Au不反应,过滤到了滤渣a中,故答案为:Au;
(4)加入氢氧化钠溶液调节PH=x,目的是生成氢氧化铝沉淀,氢氧化铝开始沉淀pH=4,沉淀完全pH=5.2,氢氧化铜开始沉淀pH=5.4,所以选择的pH范围是:5.2≤X<5.4,
故答案为:5.2≤X<5.4;
(5)由2Cu2++4I-═2CuI(白色)↓+I2、2S2O32-+I2═2I-+S4O62-可知,
反应的定量关系为:2Cu2+~I2 ~2S2O32-
1.4×10-3mol 0.100 0mol•L-1×0.014.00L=1.4×10-3mol
100ml溶液中含硫酸铜晶体物质的量为1.4×10-2mol,所以硫酸铜晶体的质量分数=$\frac{1.4×1{0}^{-2}mol×250g/mol}{4.0g}$×100%=87.5%,
故答案为:87.5%;
②依据流程分析判断,样品中含有硫酸钠,不能通过测定硫酸根离子的方法计算得到硫酸铜晶体的质量分数,故答案为:样品中含有Na2SO4等杂质;
(6)分析流程可知,滤渣C主要是氢氧铝,加入硫酸溶解后通过这蒸发浓缩,冷却结晶,过滤洗涤得到晶体Al2(SO4)3•18H2O,
故答案为:将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体.
点评 本题考查混合物的分离和提纯方法的综合应用、制备方案的设计,题目难度中等,明确实验目的和实验原理为解答关键,注意掌握铝离子、铁离子、铜离子的分离方法和性质判断,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:多选题

| A. | 浓硫酸的还原产物是SO2 | |
| B. | 该装置可随时控制反应的发生或停止 | |
| C. | ①中有白色固体生成,加水后溶液呈蓝色 | |
| D. | ②中盛放Ba(NO3)2溶液可吸收SO2,防止空气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
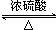 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 g D2O所含的电子数为10 NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1 NA | |
| C. | 1 mo1 Na被氧化成Na2O2,失去电子数目为2 NA | |
| D. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
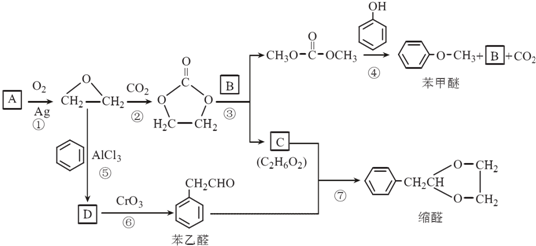
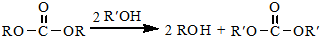
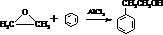 .
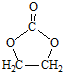
.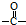 结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1.
结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1.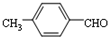 ,
,
 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备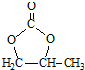 的合成路线(注明必要的反应条件).
的合成路线(注明必要的反应条件).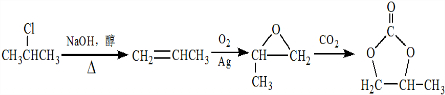 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
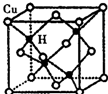 铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图所示,若CuH的密度为d g•cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示).
铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如图所示,若CuH的密度为d g•cm-3,阿伏加德罗常数的值为NA,则该晶胞的边长为$\root{3}{\frac{260}{d{N}_{A}}}$cm(用含d和NA的式子表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com