
 .图甲和图乙所表示的有机分子依次是( )
.图甲和图乙所表示的有机分子依次是( )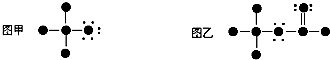
| A. | CCl3H CF3COOH | B. | CH3Cl CH3COOH | ||
| C. | CH3FHCOOCH3 | D. | CH3OH CH2OHCHO |
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: | |
| B. | Na2O2的电子式为: | |
| C. | 质子数为92、中子数为146的U原子:${\;}_{92}^{146}$U | |
| D. | 丙烯的结构式:CH3CHCH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 或
或 .
.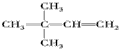 、
、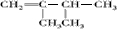 、
、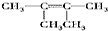 ;比烃A少2个碳原子的同系物有4种同分异构体,其中能和H2发生加成反应生成2-甲基丙烷的同分异构体的名称是2-甲基丙烯.
;比烃A少2个碳原子的同系物有4种同分异构体,其中能和H2发生加成反应生成2-甲基丙烷的同分异构体的名称是2-甲基丙烯.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铊既能与强酸反应又能与强碱反应 | B. | 能生成+3价的化合物 | ||
| C. | Tl(OH)3与Al(OH)3一样是两性氢氧化物 | D. | Tl(OH)3的碱性比Al(OH)3强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
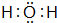 ,另一种能与E2-反应,该反应的离子方程式为4H2O2+S2-=SO42-+4H2O;
,另一种能与E2-反应,该反应的离子方程式为4H2O2+S2-=SO42-+4H2O;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
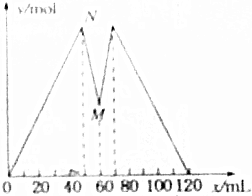 如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时,沉淀的物质的量y(mol)与加入NaOH溶和盐酸的体积x(mL)的关系图.根据图示判断,下列结论中不正确的是( )| A. | N点时溶液中的溶质只有NaCl | |
| B. | 原混合溶液中c(MgCl2):c(AlCl3)=1:2 | |
| C. | c(NaOH)=c(HCl) | |
| D. | M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com