



科目:高中化学 来源:不详 题型:实验题
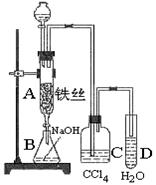
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
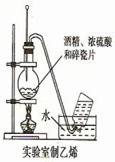


| A.用图1所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
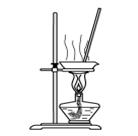
| B.用图2所示装置制取少量乙烯气体 |
| C.用图3所示装置分离CCl4萃取溴水后已分层的有机层和水层 |
| D.用图4所示装置制取少量Cl2气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠在空气中燃烧,生成淡黄色的氧化钠粉末 |
| B.镁在二氧化碳中燃烧,生成白色的氧化镁和黑色的炭 |
| C.将灼热的铁丝放人盛有氯气的集气瓶中,生成棕黄色的氯化铁烟雾 |
| D.在铜和浓硫酸加热反应后的混合液中加水,得到无色硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

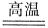 2Fe+3CO
2Fe+3CO ,此反应可用于工业上冶炼金属铁。反应中,作为氧化剂的物质是________(填化学式)。在该反应中,若消耗了1 mol
,此反应可用于工业上冶炼金属铁。反应中,作为氧化剂的物质是________(填化学式)。在该反应中,若消耗了1 mol  ,则转移了_____mol电子,生成的CO
,则转移了_____mol电子,生成的CO 在标准状况下的体积是_________L。
在标准状况下的体积是_________L。
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
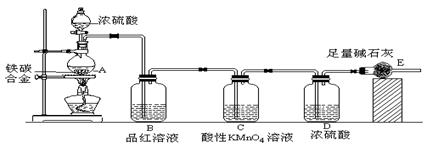
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com