
CO(g)+H2O(g) H2(g)+CO2(g)<0,在其他条件不变的情况下:
H2(g)+CO2(g)<0,在其他条件不变的情况下:
| A.加入催化剂,改变了反应的途径,反应的△H也随之改变 |
| B.改变压强,平衡不发生移动,反应放出的热量不变 |
| C.升高温度,反应速率加快,反应放出的热量不变 |
| D.若在原电池中进行,反应放出的热量不变 |
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:单选题
已知下列两个热化学方程式
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ·mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
实验测得氢气和丙烷的混和气体共5mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是( )
| A.1:3 | B.3:1 | C.1:4 | D.1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列热化学方程式中,正确的是
| A.甲烷的燃烧热△H = -890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═ CO2(g)+2H2O(g)△H = -890.3kJ/mol |
B.一定条件下,将0.5mol N2和1.5m01H2置于密闭容器中充分反应生成NH3放热19.3kJ其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H =-38.6kJ/mol 2NH3(g)△H =-38.6kJ/mol |
| C.在l01lkPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H =-571.6kJ/mol |
| D.HCI和NaOH反应的中和热△H = -57.3kJ/mol,则H2SO4和Ca(OH)2:反应的中和热△H = 2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
单斜硫和正交硫是硫的两种同素异形体。
已知:①S(s,单斜)+O2(g)=SO2 (g) △H1=-297.16kJ·mol-1
②S(s,正交)+O2(g)=SO2 (g) △H2=-296.83kJ·mol -1
下列说法正确的是
| A.S(s,单斜)=S(s,正交)△H3=+0.33kJ·mol -1 |
| B.正交硫比单斜硫稳定 |
| C.相同物质的量的正交硫比单斜硫所含有的能量高 |
| D.①式表示断裂lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量多297.16kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应既属于氧化还原反应,又是吸热反应的是
| A.铝片与稀盐酸的反应 | B.Ba(OH)2?8H2O与NH4Cl的反应 |
| C.灼热的炭与CO2的反应 | D.甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
白磷和红磷与氧气反应过程与能量的变化关系如图,E表示能量,则下列说法正确的是( )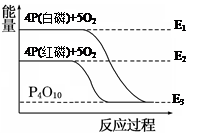
| A.白磷比红磷稳定 |
| B.白磷燃烧是吸热反应 |
| C.红磷转变为白磷是吸热反应 |
| D.红磷燃烧的热化学方程式:4P(s) + 5O2(g)=P4O10(s) ΔH=(E2-E3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是
| A.化学反应中能量变化的主要原因是化学键的断裂与生成 |
| B.铝热反应中, 反应物的总能量比生成物的总能量低 |
| C.图I所示的装置能将化学能转变为电能 |
| D.图II所示的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知2H2(g)+O2(g) →2H2O(l)+571.6kJ,2H2(g)+O2(g) →2H2O(g)+483.6kJ。下列说法正确的是
| A.2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量 |
| B.1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量 |
| C.1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量 |
| D.等质量的H2O (g)比H2O(l)所含能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.实验室制备氢气 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与水的反应 | D.铝粉与氧化铁粉末反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com