
【题目】某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。实验装置如下图所示(图中夹持、固定用的仪器未画出)。下列说法正确的是
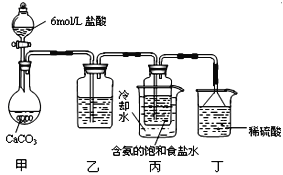
A. 乙装置中盛放的是饱和食盐水
B. 丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出
C. 丁装置中倒扣的漏斗主要作用是防止产生的气体污染空气
D. 实验结束后,分离碳酸氢钠的操作是蒸发结晶
【答案】B
【解析】
工业上侯氏制碱法是在饱和食盐水中通入氨气和二氧化碳,由于氨气在水中的溶解度大,所以先通入氨气,通入足量的氨气后再通入二氧化碳,生成了碳酸氢钠,由于碳酸氢钠的溶解度较小,所以溶液中有碳酸氢钠晶体析出,将碳酸氢钠晶体加热后得纯碱碳酸钠,据此分析解答。
A. 利用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,因此乙装置中盛放的是饱和碳酸氢钠溶液,故A错误;
B. 碳酸氢钠的溶解度比碳酸钠小,丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出,故B正确;
C. 实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,氨气极易溶于水,丁装置中倒扣的漏斗主要是防止倒吸,故C错误;
D. 分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】海洋深处有丰富的软锰矿,以此为主要原料生产MnSO4的工业流程如下:
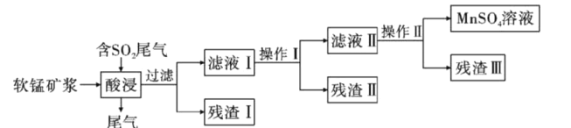
已知:①软锰矿的主要成分是MnO2,此外还含有Fe2O3、Al2O3、CuO、NiO、SiO2等少量杂质。
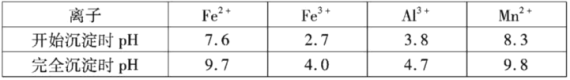
②几种离子沉淀时数据信息如下:
(1)写出酸浸过程中SO2与MnO2反应的离子方程式___________。
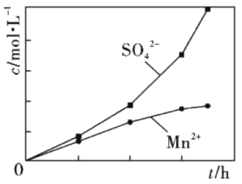
(2)为了探究MnO2与SO2反应情况,某研究小组将含有SO2尾气和一定比例的空气通入MnO2悬浊液中,保持温度不变的情况下,测得溶液中c(Mn2+)和c(SO42-)随反应时间的变化如图所示。导致溶液中c(Mn2+)和c(SO42-)的变化产生明显差异的原因是___________。
(3)操作I是“除铁铝”,其主要步骤为向滤液I中加入软锰矿,调节p=5.2~6.0左右,使其Fe3+、Al3+沉淀完全,再加入活性炭搅拌、抽滤。写出滤液I中生成Fe2+相关的离子方程式___________、___________。
(4)操作Ⅱ是“除铜镍”,其主要步骤为:向滤液Ⅱ中加入MnS(难溶物),充分搅拌,过滤。加入MnS能除去滤液Ⅱ中Cu2+和Ni2+的原因是___________。
(5)以MnSO4溶液为原料可通过电解法制备超级电容器材料MnO2,其装置如图所示:
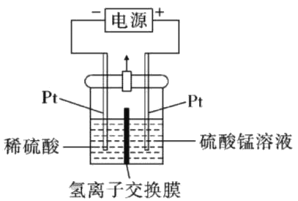
则电解过程中阳极电极反应式为___________,电解一段时间后,阴极溶液中H+的物质的量___________(填“变大”、“减小”或“不变”)。实际生产过程中___________(填“能”或“不能”)用MnCl2溶液代替MnSO4溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。

[查阅资料]①CO能与银氨溶液反应:CO+2[Ag(NH3)2]++2OH-===2Ag↓+2NH4++CO32-+2NH3。
②Cu2O为红色,不与Ag+反应,能发生反应:Cu2O+2H+===Cu2++Cu+H2O。
(1)装置A中反应的化学方程式为___________________________________________。
(2)按气流方向各装置从左到右的连接顺序为A→__________________。(填字母编号)
(3)实验中滴加稀盐酸的操作为______________________________________________。
(4)已知气体产物中含有CO,则装置C中可观察到的现象是________________;装置F的作用为_________________________________________。
(5)当反应结束后,装置D处试管中固体全部变为红色。
①设计实验证明红色固体中含有Cu2O:______________________________________________。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量0.1mol·L1AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
实验步骤(不要求写出具体操作过程) | 预期现象和结论 |
__________________ | 若观察到溶液不变蓝,则证明红色固体中含有Cu;若观察到溶液变蓝,则不能证明红色固体中含有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。总反应为![]() 。下列说法中正确的是
。下列说法中正确的是

A. a电极反应为:![]()
B. b为阳极,发生氧化反应
C. 电解一段时间b极区溶液pH升高
D. 废水中每通过6mol电子,a电极产生1molN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲烷和CO2的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用,甲烷临氧耦合CO2重整反应有:
反应①:![]()
![]()
反应②:![]()
![]()
(l)CO燃烧的热化学方程式为![]() △H=____kJ/mol
△H=____kJ/mol
(2)一定条件下,将CH4与CO2以体积比1:1置于恒温恒容的密闭容器中发生反应![]() ,下列能说明反应达到平衡状态的有____。
,下列能说明反应达到平衡状态的有____。
A.体系密度保持不变 B.容器中压强保持不变
C.H2和CO的体积比保持不变 D.每消耗lmolCH4的同时生成2mol CO
(3)重整反应中存在着副反应产生的积碳问题。加入少量的Na2CO3可不断消除积碳。请用化学方程式表示其反应过程:____,![]() 。
。
(4)已知甲烷临氧藕合CO2重整反应体系中还有反应③:![]()
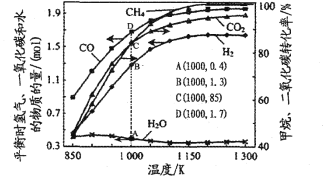
![]() 。在密闭容器中,重整反应①②③在1073K时催化下达到平衡,发现n(H2)/n(CO)<l,请从平衡移动的角度解释原因____。如果投料时增加氧气比例,下列预测可能错误的是____(填编号)。
。在密闭容器中,重整反应①②③在1073K时催化下达到平衡,发现n(H2)/n(CO)<l,请从平衡移动的角度解释原因____。如果投料时增加氧气比例,下列预测可能错误的是____(填编号)。
A.氢气总产量减少 B.反应①的甲烷转化率升高
C.会产生副反应 D.对反应②的平衡无影响
(5)温度对重整反应体系中反应物平衡转化率,平衡时氢气、一氧化碳和水的物质的量影响如图所示。若CH4与CO2的起始投料相等,则起始时n(CH4)=___mol,在1000K时反应③的平衡常数K为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种:K+ 、NO3-、SO42-、NH4+、CO32-(不考虑溶液中少量的H+和OH-),取200mL该溶液,分为两等份进行下列实验:
实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224mL
实验2:第二份先加入足量的盐酸,无现象,再加入足量的BaCl2溶液,得固体2.33g
下列说法正确的是
A.该溶液中无法确定是否含有K+
B.该溶液中肯定含有NO3-、SO42-、NH4+、CO32-
C.不能确定该溶液中是否含有NO3-
D.该溶液中一定含有K+,且c(K+)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
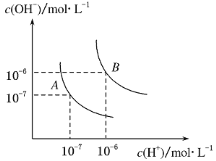
【题目】(1)水的电离平衡曲线如右图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25 ℃)________KW(100 ℃)(填“>”、“<”或“=”)。
(2)25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
已知如表数据。
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7 K2=5.6×10-11 |
(3)25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为____ ___。(填化学式)
(4)25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)。
(5)向NaCN溶液中通入少量CO2,反应的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 常温下,pH =1的盐酸中含有H+的数目为0.1NA
B. 标准状况下,22.4 LCl2与Fe完全反应时,转移电子数为3NA
C. 32gO2和32gO3中所含原子数均为2NA
D. 常温常压下,28 g乙烯含有2NA个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、Q、X、Y、Z为短周期元素且原子序数依次增大,X原子的K层电子数与M层电子数相等,Y是常用的灰黑色半导体材料,通常状态下YW4呈气态。下图是晶体Y的一种制备路线图。有关说法正确的是
![]()
A. 标准状况下,WZ为液态B. 原子半径大小为W<X<Y
C. YQ2和YW4均只含极性共价键D. 氢化物的稳定性为Q>Y>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com