
【题目】亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:
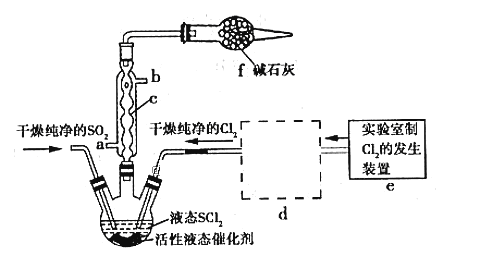
请回答下列问题:
(1)仪器c的名称是__________________
(2)实验室用二氧化锰与浓盐酸共热反应的离子方程式为_______________________
(3)已知SOCl2遇水剧烈反应,液面上产生白雾,并常有刺激性气味的气体产生。蒸干AlCl3溶液不能得到无水AlCl3,使SOCl2与AlCl3·6H2O混合加热,可得到无水AlCl3,试解释原因:_______________________________________________________
(4)装置e中产生的Cl2经过装置d(含两个洗气瓶)后进入三颈烧瓶,按Cl2的流向,第一个洗气瓶应放入的试剂是__________
(5)若反应中消耗Cl2的体积为896 mL(己转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76 g,则SOCl2的产率为__________(保留三位有效数字)。
(6)分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是________________________________________________________________________
【答案】球形冷凝管4H++2Cl-(浓)+MnO2=△=Mn2++Cl2↑+2H2OSOCl2与水反应,一方面消耗水,另一方面生成酸抑制AlCl3的水解饱和食盐水0.500或50.0%取少量W溶液于试管中,加入过量硝酸钡溶液,静置,取上层清液,滴加硝酸酸化的硝酸银,产生白色沉淀,则说明有Cl-
【解析】
(1)仪器c是球形冷凝管,故答案为:球形冷凝管;
(2)实验室氯气制备的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,离子反应方程式为:4H++2Cl-(浓)+MnO2
MnCl2+Cl2↑+2H2O,离子反应方程式为:4H++2Cl-(浓)+MnO2![]() Mn2++Cl2↑+2H2O,故答案为:4H++2Cl-(浓)+MnO2
Mn2++Cl2↑+2H2O,故答案为:4H++2Cl-(浓)+MnO2![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)SOCl2与水反应的方程式为:SOCl2+H2O=SO2↑+2HCl↑,AlCl3溶液易水解,AlCl36H2O与SOCl2混合加热,SOCl2与AlCl36H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体,SOCl2吸水,产物SO2和HCl溶于水呈酸性抑制水解发生,故答案为:SOCl2与水反应,一方面消耗水,另一方面生成酸抑制AlCl3的水解;
(4)装置e中产生的Cl2经过d后进入三颈烧瓶,d干燥氯气,且除去HCl,按氯气的流向,应先经过饱和的食盐水除去其中的HCl,然后经过浓硫酸洗气除去水蒸气,故答案为:饱和食盐水;
(5)消耗氯气为0.896L÷22.4L/mol=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,则SOCl2的产率为4.76g÷(0.08mol×119g/mol)×100%=50%,故答案为:50%;
(6)SOCl2中加入足量NaOH溶液后溶液中含有亚硫酸根离子,为排除亚硫酸根离子对氯离子的干扰,应先加入硝酸钡将亚硫酸根离子转化为硫酸钡而除去,故答案为:取少量W溶液于试管中,加入过量硝酸钡溶液,静置,取上层清液,滴加硝酸酸化的硝酸银,产生白色沉淀,则说明有Cl-。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】能在下列溶液中大量共存的离子组是( )
A.含有大量Al3+的溶液:Na+、SO42﹣、Cl﹣
B.能使酚酞变红的溶液:Na+、Ca2+、CO32﹣
C.含有大量Fe3+的溶液:OH﹣、Mg2+、Cl﹣
D.含有大量HCO3﹣的溶液:H+、SO42﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH﹣ , CO32﹣ , AlO2﹣ , SiO32﹣ , SO42﹣ , K + , Na + , Fe3 + , Mg2 + , Al3 + 等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是
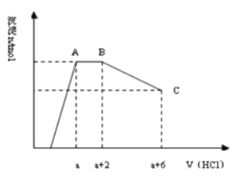
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32﹣与AlO2﹣的物质的量比为3:4
D.原溶液中一定含有的离子是OH﹣,CO32﹣,SiO32﹣,AlO2﹣,K +
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以软锰矿粉(主要含有MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制备高纯MnO2的流程如下图所示:

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子物质的量浓度小于或等于1×10-5mol·L-l时,可视为该金属离子已被沉淀完全。
(1) “酸浸”时加入一定量的硫酸,硫酸不能过多或过少。“硫酸”过多造成氨的损失;硫酸过少时,“酸浸”时会有红褐色渣出现,原因是________________________。
(2)加入氨水应调节pH的范围为__________________,当Fe3+恰好沉淀完全时,c(Al3+)=_____________mol·L-l。
(3)“过滤”所得滤渣为MnCO3,滤液中溶质的主要成分是____________(填化学式),写出其阳离子的电子式:_______________________________。
(4)加入碳酸氢铵产生沉淀的过程称为“沉锰”。
①“沉锰”过程中放出CO2,反应的离子方程式为_______________________________。
②“沉锰”过程中沉锰速率与温度的关系如图所示。当温度高于60℃时,沉锰速率随着温度升高而减慢的原因可能是________________________________________________。

(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液。取其中20.00mL,恰好与25.00mL 0.0800mol·L-1 Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算可得该样品纯度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究氨基甲酸铵(NH2COONH4)分解的化学平衡和水解反应速率。
(1)将一定量纯净的氨基甲酸铵置于固定容积为 100mL 的密闭真空溶液 A 中,在恒定温度下使其达到分解 平衡。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总物质的量(mol) | 0.34 | 0.48 | 0.68 | 0.94 |
①氨基甲酸铵分解的化学方程式为 NH2COONH4(s) 2NH3(g)+CO2(g),若 25.0℃时达到平衡所用时间为8min,根据数据计算 NH3 的平均生成速率为__________。
②可以判断该分解反应已经达到化学平衡的是_____。
A. 2v(NH3)正=v(CO2)逆
B.密闭容器中总压强不变
C. 密闭容器中混合气体的密度不变
D. 密闭容器中氨气的体积分数不变
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵 溶液测定水解反应速率,得到 c(NH2COO-)随时间变化趋势如图所示。根据图中信息,如何说明水解反应速率随温度升高而增大:_____。

(3)合成氨工业对国民经济和社会发展具有重要意义。工业合成氨常用的催化剂是_____,氨分子的电子式是_____。
(4)如图是一定的温度和压强下时 N2 和 H2 反应生成 1molNH3 过程中能量变化示意图,请写出工业合成氨的热化学反应方程式:__________________________。(热量 Q 的数值使用含字母 a、b 的代数式表示)

(5)在催化剂存在下,NH3 可用来消除 NO 的污染,生成两种对环境无害的物质。写出反应的化学方程式:_____________________;该反应中氧化产物与还原产物的物质的量之比是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“试剂”和“试管中的物质”不能完成“实验目的”的是

实验目的 | 试剂 | 试管中的物质 | |
A | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯②苯酚溶液 |
B | 甲基对苯环活性有影响 | 酸性KMnO4溶液 | ①苯②甲苯 |
C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯②己烯 |
D | 碳酸的酸性比苯酚强 | 石蕊溶液 | ①苯酚溶液②碳酸溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】严重的雾霾天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。
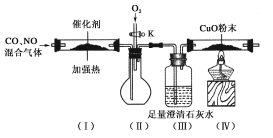
(1)装置(Ⅲ)的主要作用为________________________。
(2)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是___________________。
(3)该套装置中有不完善之处,还应在装置(Ⅳ)后补充____________。
(4)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3===NaNO2+NaNO3+CO2、NO2+NO+Na2CO3===2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,则a、b应满足的关系为________。Na2CO3溶液的物质的量浓度为________mol·L-1(不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】范德华力为a kJ·mol-1,化学键为b kJ·mol-1,氢键为c kJ·mol-1,则a、b、c的大小关系正确的是
A. a>b>cB. b>a>cC. c>b>aD. b>c>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com