
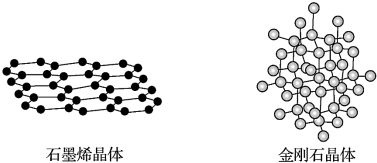
| A. | 在石墨烯晶体中,每个C原子连接3个六元环 | |
| B. | 在石墨烯晶体中,每个六元环占有3个C原子 | |
| C. | 在金刚石晶体中,C原子所连接的最小环为六元环,每个7C原子连接12个六元环 | |
| D. | 在金刚石晶体中,六元环中最多有4个C原子在同一平面 |
分析 A.石墨烯晶体中最小的环为六元环,每个碳原子连接3个C-C化学健;
B.每个C-C化学健被2个碳原子共用;
C.在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接4个碳原子,连接的4个C原子中每个C原子形成3个六元环;
D.在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,这5个碳原子形成的是正四面体结构,键角为109028,最小的环为6元环.
解答 解:A.石墨烯晶体中最小的环为六元环,每个碳原子连接3个C-C化学健,则每个C原子连接3个六元环,故A正确;
B.每个六元环占有的C原子数为6×$\frac{1}{3}$=2,故B错误;
C.在金刚石晶体中,C原子所连接的最小环为六元环,每个C原子连接4个碳原子,连接的4个C原子中每个C原子形成3个六元环,所以金刚石晶体中每个C原子能形成12个六元环,故C正确;
D.晶胞中共平面的原子如图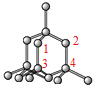 ,共4个,故D正确.
,共4个,故D正确.
故选:B.
点评 本题考查物质结构和性质,为高频考点,侧重考查学生分析判断及空间想象能力,熟悉石墨、金刚石结构特点即可解答,题目难度中等.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 丁烷的球棍模型 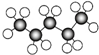 | B. | 乙烯的比例模型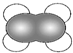 | ||
| C. | 乙醛的结构简式CH3COH | D. | 键线式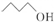 表示的有机物名称为1-戊醇 表示的有机物名称为1-戊醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 在MgCl2与AlCl3溶液中分别加入过量的NaOH溶液,判断镁与铝的金属性强弱 | |
| C. | 往硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 根据HF和HCl的水溶液的酸性强弱判断氟与氯的非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b、a、d、c、e | B. | e、b、a、d、c | C. | c、b、e、a、b | D. | b、a、e、d、c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的氯原子${\;}_{17}^{37}$Cl | B. | 硫离子的结构示意图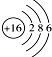 | ||
| C. | 过氧化钠的电子式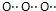 | D. | HClO的结构式H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的结构式为 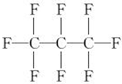 | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 全氟丙烷分子中只有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol | |
| B. | 若P4(白磷,s)=4P(红磷,s)△H=-29.2kJ/mol,则红磷比白磷稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4 kJ/mol,则20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为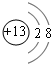 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
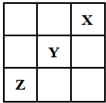 短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )| A. | Y的氢化物稳定性大于Z的氢化物稳定性 | |
| B. | Z一定是活泼的金属元素 | |
| C. | Y的最高价氧化物的水化物是一种强酸 | |
| D. | 1molX的单质可以跟足量水反应,转移的电子为2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com