

| ||
| △ |
| ||
| △ |
| 8 |
| 6 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
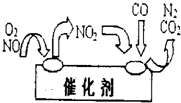 火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题:
火力发电厂燃煤排烟,释放出大量的NOx和SO2气体.启东大唐热电厂同时具有烟气脱氮和脱硫设施,成为高效、绿色环保燃煤电厂.试回答下列问题:
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com