
 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.下列说法不正确的是( )| A. | 该反应的化学方程式为3X+Y?2Z | |
| B. | 容器内混合气体的平均摩尔质量保持不变表明该反应一定达到平衡状态 | |
| C. | 平衡时,体系的压强是开始时的1.8倍 | |
| D. | 平衡时,Y的体积分数为50% |
分析 A.从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3 mol、0.1 mol,Z的生成的物质的量为0.2 mol,因此三者比例为3:1:2,物质的量变化之比等于化学计量数之比;
B.结合M=$\frac{m}{n}$及变量可判定平衡状态;
C.反应前后的物质的量比等于压强比;
D.平衡时Y为0.9mol,X为0.7mol,Z为0.2mol,体积分数等于物质的量分数,以此来解答.
解答 解:A.从曲线的变化趋势可以看出,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3 mol、0.1 mol,Z的生成的物质的量为0.2 mol,因此三者比例为3:1:2,由物质的量变化之比等于化学计量数之比,则化学方程式为3X+Y?2Z,故A正确;
B.由反应可知,该反应为气体总物质的量减小的反应,则混合气体的平均摩尔质量保持不变表明该反应一定达到平衡状态,故B正确;
C.平衡时,体系的压强是开始时的$\frac{0.9+0.7+0.2}{1.0+1.0}$=0.9倍,故C错误;
D.平衡时Y为0.9mol,X为0.7mol,Z为0.2mol,Y的体积分数为$\frac{0.9}{0.9+0.7+0.2}$×100%=50%,故D正确;
故选C.
点评 本题考查物质的量随时间的变化曲线,为高频考点,把握图中物质的量变化、平衡判定、压强和体积与物质的量的关系为解答的关键,侧重分析与应用能力的考查,注意化学反应中化学计量数的确定方法,题目难度不大.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 将少量浓氨水滴入Al2(SO)4溶液 将少量Al2(SO4)3溶液滴入浓氨水 | |
| B. | 将少量SO2通入Ba(OH)2溶液 将过量SO2通入少量Ba(OH)2溶液 | |
| C. | 将0.1molCl2通入含0.2molFeBr2的溶液中 将0.3molCl2通入含0.2molFeBr2溶液 | |
| D. | 将过量BaCl2溶液与少量Na2SO4溶液相混合 将少量Ba(OH)2溶液与过量MgSO4溶液相混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na放入水中,产生气体:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | FeCl3溶液滴在淀粉碘化钾试纸上,试纸变蓝:2Fe3++2I-═2Fe2++I2 | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 氯气溶于水:Cl2+H2O?H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2$\stackrel{煅烧}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{点燃}{→}$Na2O2 | |
| C. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH}{→}$Fe(OH)2$\stackrel{空气中的灼烧}{→}$Fe2O3 | |
| D. | Fe2O3$\stackrel{盐酸}{→}$FeCl3(aq)$\stackrel{Cu}{→}$Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
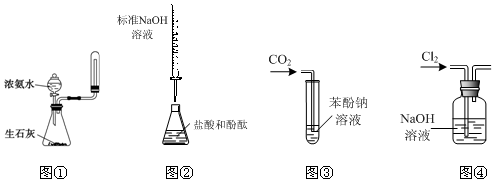
| A. | 实验室利用图①装置制取并收集氨气 | |
| B. | 利用图②装置测定盐酸的浓度 | |
| C. | 利用装置③验证碳酸的酸性强于苯酚 | |
| D. | 利用图④装置除去Cl2中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  利用图装置,可快速制取氨气 | |
| B. |  利用图装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液 | |
| C. |  利用图装置,可制取乙酸乙酯 | |
| D. |  利用图装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0×10-5 | B. | 0.001mol/L | C. | 1.8×10-7 | D. | 0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
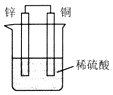
| A. | 锌是负极,其质量逐渐减少 | |
| B. | 电子由铜片经导线流向锌片 | |
| C. | H+在铜片表面被还原,产生气泡 | |
| D. | 锌片上发生氧化还原,铜片上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化钇(Y2O3)、氧化锆(ZrO2)为解质,这种电解质在高温熔融状态下允许氧离子(O2-)在其间通过.某甲醇燃料电池的工作原理如图所示,两个多孔电极均不参与电极反应.下列有关该燃料电池的说法错误的是(已知每摩尔电子所携带的电量为9.65×104C/mol)( )
固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化钇(Y2O3)、氧化锆(ZrO2)为解质,这种电解质在高温熔融状态下允许氧离子(O2-)在其间通过.某甲醇燃料电池的工作原理如图所示,两个多孔电极均不参与电极反应.下列有关该燃料电池的说法错误的是(已知每摩尔电子所携带的电量为9.65×104C/mol)( )| A. | 该燃料电池的负极反应式为CH3OH-6e-+3O2-═CO2↑+2H2O | |
| B. | 若有16g甲醇发生反应,该电池理论上提供的电量最多为2.895×105C | |
| C. | 氧气在负极发生还原反应 | |
| D. | O2-在电解质中的移动方向为:正极→负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com