
【化学——选修3:物质结构与性质】(15分)A、B、C、D、E为原子序数依次增大的四种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。回答下列问题:
(1)D原子的核外电子排布式为 ,E的价层电子轨道示图为______________。
(2)单质B有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;
(3)A、B、C中第一电离能最大的是________(填元素符号),其中A的氢化物(AH3)分子中,A原子轨道的杂化类型是 。
(4)化合物D2B的立体构型为 ,单质D与湿润的Na2CO3反应可制备D2B,其化学方程式为 .
(5)E与C所形成化合物晶体的晶胞如图所示。
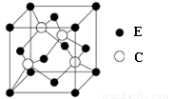
①在1个晶胞中,E离子的数目为 。
。
②该化合物的化学式为 。
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源:2016届山东省高三上学期开学考试化学试卷(解析版) 题型:实验题
(12分)氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。完成下列填空:
实验室设计了如图所示的实验装置,进行“氨的催化氧化”等实验。

(1)A处是气体发生装置,A中所用试剂只能从下列物质中选取:
①硝酸铵 ②碳酸氢铵 ③氯化铵 ④熟石灰 ⑤氢氧化钠
若A中制取气体时只用了一种试剂,该试剂可以是____________(选填上述编号),此时A处的装置应为______________(选填下列编号)。


至此,完成了对图1中装置的补充。某同学从安全与环保的角度考虑,该装置存在两处明显的缺陷,你认为这两处缺陷是______________ 、_________________。
(2)写出图1装置B中发生反应的化学方程式(写一个即可) ;
在图1中,若A、B处试剂足量,则装置E中发生反应的离子方程式为:____________________。
(3)写出图1装置C中发生反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三上学期起点考试化学试卷(解析版) 题型:填空题
(9 分)碳元素是形成物种最多的元素之一,其中许多物质对人类来说有着极其重要的作用。
(1)石墨烯是一种由碳原子构成的单层片状结构的新材料,它是世界上最薄却也是最坚硬的纳米材料,同时也是导电性最好的材料。下列物质在一定条件下能与它反应的是________(填字母)。
A.氧气 B.单质氟 C.氢氧化钠溶液 D.浓硝酸
(2)①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②CO(g)+2H2(g)=== CH3OH(g) ΔH=-91kJ·mol-1
则CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_____________。
(3)工业中用乙苯为原料,采用催化脱氢的方法制取苯乙烯的反应方程式为:
C6H5-CH2CH3(g) C6H5-CH=CH2(g)+H2(g)△H1
C6H5-CH=CH2(g)+H2(g)△H1
向体积为VL 的密闭容器中充入a mol 乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示,在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:


①计算600℃温度下该反应的平衡常数 。
②分析上述平衡体系组成与温度的关系图可知:△H1 0(填“>、=或<” )。
(4)某科研组设计如图装置,模拟“人工树叶”电化学实验装置如右图所示,该装置能将H2O 和CO2 转化为O2 和燃料(C3H8O)。该装置工作时,a 电极的反应为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一下学期期末考试化学试卷(解析版) 题型:选择题
除去乙烷中混有的少量乙烯,应采用的简便方法是
A.将混合气体通过氢氧化钠溶液 B. 将混合气体通过溴水
将混合气体通过溴水
C.将混合气体在催化剂条件下跟氢气反应 D .使混合气体中的乙烯气体发生加聚反应
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三7月月考化学试卷(解析版) 题型:填空题
[化学选修——2.化学与技术](15分)碳酸钠是一种重要的化学基本工业产品。比利时人索尔维发明了氨碱法生产碳酸钠,氨碱法生产原理示意图如下:
我国化工专家设计了联合制碱法,联合制碱法生产原理示意图如下: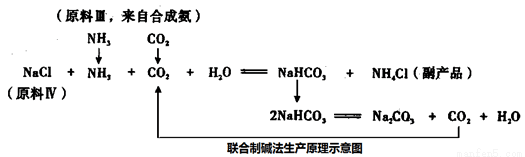
请回答下列问题:
(1)从索尔维制碱法生产原理示意图可知,氨碱法的总反应方程式为 ______________。按照绿色化学原则,理想的“原子经济”就是反应物的原子全部转化为期望的最终产物,实现废弃物的零排放。计算索尔维制碱法的原子利用率(原子利用率=期望产物的总质量与生成物的总质量之比)______________。
(2)试列举出索尔维制碱法的两大缺点。
①______________;②_____________。
(3)设计联合制碱法的我国化工专家是______________;
(4)从联合制碱法生产原理示意图可知,原料III 中的CO2来自合成氨,指出步骤名称,并写产生CO2化学方程式。
步骤I:__________,化学方程式_________________,
步骤II:__________,化学方程式__________。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三9月月考化学试卷(解析版) 题型:填空题
(9分)O2和O3是氧元素的两种单质,根据其化学式完成下列各题:
(1)等质量的O2和O3所含分子个数比为______,原子个数比为________,分子的物质的量之比为______。
(2)等温等压下,等体积的O2和O3所含分子个数比为________,原子个数比为________,质量比为_______。
(3)配制100 mL 1 mol·L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84 g·mL-1,质量分数为98%)的体积为________mL(写计算过程)。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三第一次月考化学试卷(解析版) 题型:选择题
将ag Fe2O3、Al2O3样品溶解在过量的200 mL 0.05 mol/L的硫酸溶液中然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.4 mol·L-1 D.0.8 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016届河南省濮阳市心高三上第一次市统摸底化学试卷(解析版) 题型:填空题
(7分)某消毒液的主要成分为 NaClO(混有少量 NaCl),请用相应的化学用语来解释下列事实。
(1)该消毒液可用NaOH溶液吸收 Cl2 制备,化学方程式为__________。
(2)该消毒液的 pH 约为 12,离子方程式为________________。
(3)向 FeSO4 溶液中滴入少量该溶液,溶液颜色变成棕黄色,反应的离子方程式为_______________。
(4)该消毒液不能与洁厕灵(主要成分为浓盐酸)混用,否则会产生中毒危险。若将二者混合,每产生 1 mol Cl2,转移电子个数约为_____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省白城市高一上第一次月考化学试卷(解析版) 题型:选择题
A、B、C、D可能是Na2CO3、HCl、AgNO3、BaCl2四种无色溶液中的某一种,把它们两两混合后产生的现象如下表,则A、B、C、D四种物质按顺序排列正确的是
反应物 | A+B | A+C | B+C | C+D | B+D |
现象 | 白↓ | 白↓ | 白↓ | 白↓ | 无色↑ |
A.BaCl2、 Na2CO3、 AgNO3、 HCl
B.Na2CO3、 HCl、 AgNO3、 BaCl2
C.HCl、 AgNO3、 Na2CO3、 BaCl2
D.AgNO3、 Na2CO3、 BaCl2、 HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com