考点:晶胞的计算,原子核外电子排布,共价键的形成及共价键的主要类型,“等电子原理”的应用,原子轨道杂化方式及杂化类型判断,氢键的存在对物质性质的影响
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)X是元素周期表原子半径最小的元素,为氢元素;Y原子基态时最外层电子数是其内层电子数的2倍,所以Y为碳元素,Z原子基态时2p原子轨道上有3个未成对的电子,即电子排布为1s
22s
22p
3,所以Z为氮元素,w的原子序数为29,所以W为铜元素;由此可以分析①Y
2X
2分子为C
2H
2中C原子轨道的杂化类型为sp杂化,1molC
2H
2含有σ键的数目为3mol,据此答题;
②化合物ZX
3为NH
3,化台物YX
4为CH
4,因为氨分子之间存在氢键,所以氨气的沸点比甲烷高,据此答题;
③根据等电子体概念,可以写出碳的氧化物与氮的氧化物为等电子体的是CO
2和N
2O,据此答题;
(2)①Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;
②配合物Fe(CO)
x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;分子晶体的熔沸点较低.
(3)O和Na形成的一种只含有离子键的离子化合物为Na
2O,该晶胞结构中黑球有8×
+6×
=4,白球在内部,共有8个,所以黑球为O
2-,以晶胞中上面心O
2-离子为研究对象,距一个O
2-周围最近的Na
+离子有8个,位于晶胞中上层4个Na
+及上面晶胞中的下层4个Na
+,8个Na
+离子构成的几何体中每个都是正方形,形成立方体结构;计算晶胞的质量,棱长=
,据此答题;
(4)A、根据元素周期律可知,因为P为第ⅤA族元素最外层处于半充满状态,所以第一电离能大小为:P>S>Si,据此判断;
B、根据元素周期律可知,电负性顺序:C<N<O<F据此判断;
C、因为晶格能越大,离子晶体的熔沸点就越高,据此判断;
D、SO
2中硫原子有孤对电子,所以它的空间构型为V型,是极性分子,据此判断;
E、分子晶体的熔沸点与分子间作用力有关,与分子内部的共价键无关,据此判断;
解答:
解:(1)X是元素周期表原子半径最小的元素,为氢元素;Y原子基态时最外层电子数是其内层电子数的2倍,所以Y为碳元素,Z原子基态时2p原子轨道上有3个未成对的电子,即电子排布为1s
22s
22p
3,所以Z为氮元素,w的原子序数为29,所以W为铜元素;由此可以分析
①Y
2X
2分子为C
2H
2中C原子轨道的杂化类型为sp杂化,1molC
2H
2含有σ键的数目为3mol,故答案为:sp杂化; 3 N
A或3×6.02×10
23;
②化合物ZX
3为NH
3,化台物YX
4为CH
4,因为氨分子之间存在氢键,所以氨气的沸点比甲烷高,故答案为:NH
3分子间存在氢键;
③根据等电子体概念,可以写出碳的氧化物与氮的氧化物为等电子体的是CO
2和N
2O,故答案为:N
2O;
(2)①Fe原子核外有26个电子,核外电子排布为1s
22s
22p
63s
23p
63d
64s
2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe
3+,Fe
3+电子排布式为1s
22s
22p
63s
23p
63d
5,则M层电子排布式为:3s
23p
63d
5,故答案为:3s
23p
63d
5;
②配合物Fe(CO)
x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,故答案为:5;分子晶体.
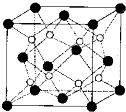
(3)由Na
2O晶胞结构结构可知,晶胞中黑色球数目为8×
+6×
=4,白色球数目=8,故白色球为Na
+离子、黑色球为O
2-,以晶胞中上面心O
2-离子为研究对象,距一个O
2-周围最近的Na
+离子有8个,位于晶胞中上层4个Na
+及上面晶胞中的下层4个Na
+,8个Na
+离子构成的几何体中每个都是正方形,形成立方体结构;
该晶胞质量=4×
g,该晶胞的密度为ρ g?cm
-3,则晶胞边长a=
=
cm,
故答案为:立方体结构;
cm.
(4)A、根据元素周期律可知,因为P为第ⅤA族元素最外层处于半充满状态,所以第一电离能大小为:P>S>Si,故A错误;
B、根据元素周期律可知,电负性顺序:C<N<O<F,故B正确;
C、因为晶格能越大,离子晶体的熔沸点就越高,故C正确;
D、SO
2中硫原子有孤对电子,所以它的空间构型为V型,是极性分子,故D错误;
E、分子晶体的熔沸点与分子间作用力有关,与分子内部的共价键无关,故E错误;
故答案为:BC.
点评:本题考查了元素的推断、核外电子排布、等电子体、配合物、氢键、晶胞的计算、元素周期律等知识,涉及的知识点较多,有一定的综合性,解题是要求能熟练掌握基础知识,有一定的难度.

 (1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29.回答下列问题:
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29.回答下列问题:

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案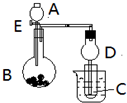 用如图所示装置进行实验,将A逐滴加入B中:
用如图所示装置进行实验,将A逐滴加入B中: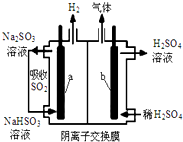 电解法在污染处理上有广泛应用,下面是两例具体应用.
电解法在污染处理上有广泛应用,下面是两例具体应用.