
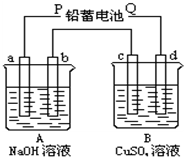
 用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).
用如图装置实验,A、B两烧杯分别盛放200g10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).分析 (1)A、B为电解池,电解时,c电极上有Cu析出,则c为阴极,电解质溶液中的铜离子放电生成单质铜,d为阳极,A、B为串联,所以a是阴极、b是阳极,阴离子氢氧根离子放电,生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑,P是负极、Q是正极;
(2)A杯是电解水,A杯中溶液的质量减少4.5g,所以水的质量减少4.5g,物质的量为:$\frac{4.5g}{18g/mol}$=0.25mol,析出氧气物质的量为$\frac{0.25mol}{2}$=0.125mol,根据转移电子数相等计算c电极析出金属质量;
(3)a电极是阴极,阴极上析出氢气,根据转移电子相等进行计算.
解答 解:(1)A、B为电解池,电解时,c电极上有Cu析出,则c为阴极,电解质溶液中的铜离子放电生成单质铜,d为阳极,A、B为串联,所以a是阴极、b是阳极,阴离子氢氧根离子放电,生成氧气,电极反应式为:4OH--4e-=2H2O+O2↑,P是负极、Q是正极,
故答案为:负,4OH--4e-=2H2O+O2↑;Cu2++2e-=Cu;
(2)水的质量减少4.5g,物质的量为:$\frac{4.5g}{18g/mol}$=0.25mol,析出氧气物质的量为0.125mol,根据4OH--4e-=2H2O+O2↑得转移电子的物质的量=0.125mol×4=0.5mol,串联电路中转移电子相等,所以析出Cu的质量=$\frac{0.5mol}{2}$×64g/mol=16g,
故答案为:16;
(3)a电极是阴极,阴极上析出氢气,a极制得氢气0.050mol,转移电子0.10mol,铅蓄电池总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,则电池内消耗的H2SO4的物质的量至少是0.10mol,
故答案为:0.10.
点评 本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等.


科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液中水的电离程度小于Na2SO3 溶液,也小于Na2SO4 溶液 | |
| B. | [HSO3-]>[SO32-]>[H2SO3 ] | |
| C. | 该溶液中由水电离出的[H+]为1×10-4mol/L | |
| D. | 加入少量NaOH使溶液的pH升高会使水的电离受到抑制 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 436kJ | B. | 557kJ | C. | 872kJ | D. | 181kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
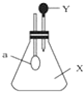 如图所示,锥形瓶中盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,震荡,过一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图所示,锥形瓶中盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,震荡,过一会儿可见小气球a鼓起.气体X和液体Y不可能是( )| A. | X是NH3,Y是水 | B. | X是CO2,Y是饱和NaHCO3浓溶液 | ||
| C. | X是SO2,Y是NaOH溶液 | D. | X是HCl,Y是NaNO3稀溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
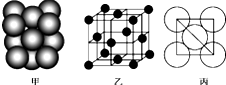 铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.
铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥ | B. | ①⑤⑦ | C. | ③④⑤⑥ | D. | ②③④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 足量溶液A |
| 充分反应 |
| 足量溶液B |
| 充分反应 |
| A. | 溶液A和B均可以是盐酸 | B. | 溶液A和B均可以是NaOH溶液 | ||
| C. | 溶液A和B均可选用稀硝酸 | D. | 实验室中方案Ⅱ更便于实施 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com