
| A. | 2Fe3++SO2+2H2O═2Fe2++SO42ˉ+4H+ | B. | Cl2+SO2+2H2O═H2SO4+2HCl | ||
| C. | 2 Fe3++2Cl-═2 Fe2++Cl2↑ | D. | 2 Fe2++I2═2 Fe3++2I- |
分析 根据氧化还原反应中还原剂的还原性大于还原产物的还原性,利用酸性溶液中还原性强弱的顺序是SO2>I->Fe2+>Cl-来判断反应能否发生.
解答 解:A、因该反应中S元素的化合价升高,Fe元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>Fe2+,与已知的还原性强弱一致,故A能发生;
B、因该反应中S元素的化合价升高,Cl元素的化合价降低,则SO2为还原剂,还原性强弱为SO2>Cl-,与已知的还原性强弱一致,故B能发生;
C、若该反应发生,Fe元素的化合价降低,Cl元素的化合价升高,则Cl-为还原剂,还原性强弱为Cl->Fe2+,与已知的还原性强弱矛盾,故C不可能发生;
D、因该反应中Fe元素的化合价升高,Cl元素的化合价降低,则Fe2+为还原剂,还原性强弱为Fe2+>I-,与已知的还原性强弱一致,故D不可能发生;
故选CD.
点评 本题考查学生利用已知的还原性强弱来判断化学反应的发生,学生应学会利用化合价来分析反应中的还原剂,并利用还原剂的还原性大于还原产物的还原性来解答即可.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min Z的平均速率υ(Z)=2.0×10-3 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正) | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
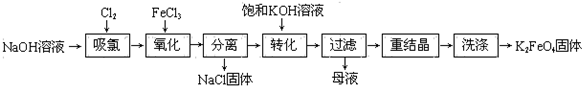
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯中的溶液没有恢复到室温就转移到容量瓶,一定会导致结果偏高 | |
| B. | 没有洗涤烧杯和玻璃棒,一定会导致结果偏低 | |
| C. | 容量瓶使用时没有干燥会导致结果偏低 | |
| D. | 使用量筒量取浓溶液后,没有把洗涤量筒得到洗涤液转移到容量瓶,会导致结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物不一定是电解质,共价化合物可能是强电解质 | |
| B. | 强电解质都是离子化合物,而弱电解质都是共价化合物 | |
| C. | 电解质的水溶液都具有较强的导电性 | |
| D. | 易溶性强电解质的溶液中不存在溶质分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发的过程中,用酒精灯一直加热到全部固体析出 | |
| B. | 过滤时,为了加快过滤速率,可用玻璃棒在过滤器内搅拌 | |
| C. | 对医用酒精进行蒸馏操作可得到更高纯度的酒精溶液 | |
| D. | 分液漏斗盛装的是液体,振荡后不必扭开旋塞把气体放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com