
分析 (1)降低压强平衡向气体体积增大的方向移动,据此判断;
(2)C是气体,且且a+b=c,增大压强平衡向气体体积减小的方向移动;
(3)加热后,C的百分含量减小,说明升高温度平衡向逆反应移动.
解答 解:(1)A、B、C都是气体,在减压后平衡向逆反应方向移动,降低压强平衡向气体体积增大的方向移动,即a+b>c,
故答案为:a+b>c;
(2)A为固体、B为无色气体,C是有色气体,且a+b=c,在加压时化学平衡可发生移动,缩小体积加压时,逆反应是气体体积减小的反应,故平衡向逆反应方向移动,气体的颜色将变浅,但增大压强体积减小增大物质浓度,气体颜色比原来要深,气体的颜色将加深,故答案为:加深;
(3)加热后,C的百分含量减小,说明升高温度平衡向逆反应移动,故正反应是放热反应,故答案为:放.
点评 本题考查化学平衡的影响因素,难度不大,注意压强对平衡移动的影响,化学平衡移动原理的理解应用是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯和甲苯均能使酸性高锰酸钾溶液褪色 | |
| B. | 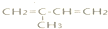 与等物质的量的溴反应产物仅有2种 与等物质的量的溴反应产物仅有2种 | |
| C. | 分子式为C8H10且属于芳香烃的同分异构体有3种 | |
| D. | 等质量的乙烷、乙烯完全燃烧消耗氧气的量前者多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1 | B. | 0.1mol•L-1 | C. | 0.3mol•L-1 | D. | 3.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
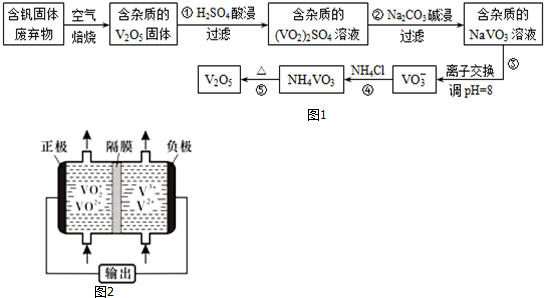
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图a中,随着电解的进行,溶液中c(H+)增大 | |
| B. | 图b中,Mg电极做电池负极 | |
| C. | 图c中,发生的反应为Co+Cd2+=Cd+Co2+ | |
| D. | 图d中,K分别与M、N连接,Fe电极均受到保护 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +NaOH→
+NaOH→ +CH3OH.
+CH3OH. ,化合物Ⅳ通过消去反应生成化合物I的化学方程式为
,化合物Ⅳ通过消去反应生成化合物I的化学方程式为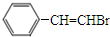 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O(注明反应条件).
+NaBr+H2O(注明反应条件).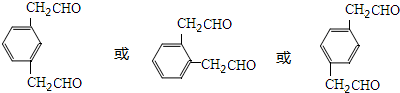
 单体的结构简式为
单体的结构简式为
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com