
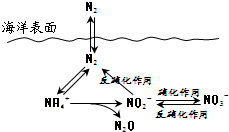
| A. | 反硝化作用中N元素均被氧化 | |
| B. | N元素所形成的化合物均易溶于水 | |
| C. | N2性质活泼可与多种物质发生反应 | |
| D. | 向海洋排放含NO3-的废水可能影响海洋中N元素循环 |
分析 A.反硝化作用是指将硝酸盐转变成氮气的过程.硝化作用是指氨在微生物作用下氧化为硝酸的过程.硝化细菌将氨氧化为硝酸的过程.反硝化作用:反硝化细菌在缺氧条件下,还原硝酸盐,释放出分子态氮(N2)或一氧化二氮(N2O)的过程;
B.氮的氧化物不一定溶于水;
C.氮气分子结构可知存在三键结构,性质稳定;
D.转化关系图中硝酸根离子增多,反硝化作用增强.
解答 解:A.反硝化作用:反硝化细菌在缺氧条件下,还原硝酸盐,释放出分子态氮(N2)或一氧化二氮(N2O)的过程,氮元素化合价降低被还原,故A错误;
B.氮的氧化物不一定溶于水如NO、N2O等不溶于水,故B错误;
C.氮气分子结构可知存在三键结构,性质稳定,一定条件下可以和其他物质反应,故C错误;
D.转化关系图中硝酸根离子增多,反硝化作用增强,向海洋排放含NO3-的废水会影响海洋中NH4+的含量,影响海洋中N元素循环,故D正确;
故选D.
点评 本题考查了氮及其化合物在自然界中的循环过程分析判断,主要是硝化作用和反硝化作用的理解应用,题目难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | 25℃时,PH=1的醋酸溶液中含有H+的数目小于0.1NA | |
| C. | 在NaHS溶液中滴入CuCl2溶液产生黑色沉淀,HS-水解程度增,pH增大 | |
| D. | 3种pH相同的溶液①CH3COONa ②NaHCO3 ③NaOH中c(Na+)的大小是①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的名称可能为 2-甲基-5-乙基己烷 | |
| B. | 苯的四氯代物共有三种不同的结构 | |
| C. | 等物质的量的乙烯与碳酸二甲酯(CH3OCOOCH3)完全燃烧的耗氧量不同 | |
| D. | 同为高分子化合物的淀粉、植物油和蛋白质,其水解产物中均含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B、C、D的离子半径大小比较:C>D>B | |
| B. | 元素E的最高价氧化物对应水化物的酸性比D的强 | |
| C. | 元素B分别与A、C形成的化合物中化学键的类型完全相同 | |
| D. | 均含A、B、C、D四种元素的化合物X和Y在溶液中可发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
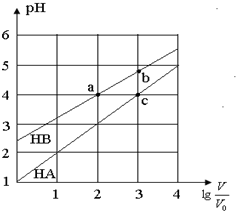 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数a<b | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 相同条件下NaA溶液的pH小于NaB溶液的pH | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若同时微热两种溶液(不考虑HA、HB和H2O的挥发),则$\frac{c({B}^{-})}{c({A}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 乙元素只能形成一种二元含氧酸 | |
| C. | 另一个化合物G与B具有相同的元素组成,G是一种常见的强氧化剂 | |
| D. | 1.0L 0.1 mol/L E溶液中阴离子的总的物质的量小于0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:D>C>B>A | D. | 金属性:B>A,非金属性:D>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com