
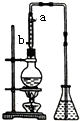
 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\underset{\stackrel{{H}^{+}}{→}}{\;}$n(C2H4O).
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\underset{\stackrel{{H}^{+}}{→}}{\;}$n(C2H4O).分析 (1)久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液,因此分离时可选择分液漏斗通过分液进行操作;
(2)乙醛在溶液中易被氧化,若乙醛被氧化,则生成CH3COOH,下层液呈酸性,可以利用石蕊试液检验下层液是否呈酸性;
(3)①蒸馏操作时会有部分加合物随温度的升高再挥发,如果不使用冷凝管使之液化后重新流入烧瓶内,会使得到的乙醛不纯,另外原料利用率也低;
②气泡从下到上升至液面过程中,体积越来越小,直至完全消失,说明气体溶于溶液,当观察到导气管中气流很小时,要将导管从溶液中 取出,以防止倒吸,据此答题.
解答 解:(1)久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液,先分离混合物得到(C2H4O)n,基本方法是:将混合物放入分液漏斗中,静置分层后,打开活塞,将下层液体放入烧杯中,然后把上层的油状液体(C2H4O)n从分液漏斗的上口倒出,分离操作名称为分液,
故答案为:分液漏斗;分液;
(2)乙醛在溶液中易被氧化,若乙醛被氧化,则生成CH3COOH,下层液呈酸性,可以利用石蕊试液检验下层液是否呈酸性,具体操作为:取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化,
故答案为:取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化;
(3)①利用冷凝管使挥发出的加合物液化后重新流入到烧瓶内,这样既保证了乙醛的纯度,也提高了原料的利用率,冷凝时冷却水的方向与蒸汽的流向相反,应该是低时高出,
故答案为:使加合物冷凝回流到烧瓶内;b;
②气泡从下到上升至液面过程中,体积越来越小,直至完全消失,说明乙醛易溶于水,当观察到导气管中气流很小时,要将导管从溶液中 取出,以防止倒吸,
故答案为:易溶于水;及时撤去导管;防止倒吸.
点评 本题考查混合物的分离和提纯、实验方案设计、乙醛的性质等,注意化学实验中安全意识的渗透、制备实验中原料尽可能充分利用,难度中等.


科目:高中化学 来源: 题型:选择题
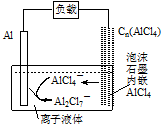 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 充电时,阴极发生:4Al2Cl7-+3e-═Al+7AlCl4- | |
| B. | 充电时,泡沫石墨极与外电源的负极相连 | |
| C. | 放电时,负极发生:2AlCl4--e-═Al2Cl7-+Cl- | |
| D. | 放电时,电路中每流过3mol电子,正极减少27g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量稀硝酸反应,转移电子的数目为0.2 NA | |
| B. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| C. | 8.8g乙酸乙酯中含共用电子对数为1.4 NA | |
| D. | 1 L 0.1 mol•L-1氯化铜溶液中铜离子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
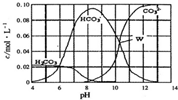 25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A. | W点所示的溶液中:c(Na+)+c(H+)=4c(CO32-)+c(OH-)+c(Cl-) | |
| B. | pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol/L | |
| C. | pH=8的溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-) | |
| D. | pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
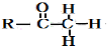 +
+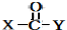 $\stackrel{O{H}^{-}}{→}$
$\stackrel{O{H}^{-}}{→}$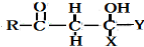
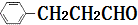 )的路线流程图.路线流程图示例如下:
)的路线流程图.路线流程图示例如下: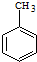 $→_{光}^{Cl_{2}}$
$→_{光}^{Cl_{2}}$ 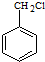 $→_{△}^{NaOH/H_{2}O}$
$→_{△}^{NaOH/H_{2}O}$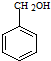
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
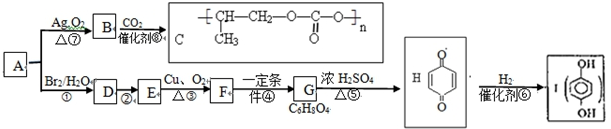
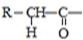 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$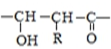
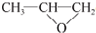 ;⑤的反应类型是消去反应.
;⑤的反应类型是消去反应.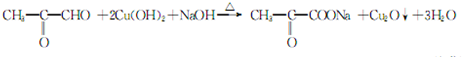 ;
;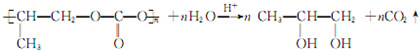 .
.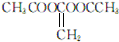 或
或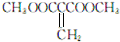 )(任写两种)
)(任写两种)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
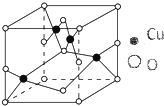 纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色.
纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn与稀硫酸反应制取H2时,加入蒸馏水 | |
| B. | Al在O2中燃烧生成Al2O3时,用铝粉替代铝片 | |
| C. | CaCO3与稀盐酸反应生成CO2时,适当升高温度 | |
| D. | 用KClO3固体分解制取O2时,固体中添加少量MnO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com