
等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合,离子方程式正确的是()
A. HCO3﹣+OH﹣→H2O+CO32﹣
B. 2 HCO3﹣+Ba(OH)2→BaCO3↓+2H2O+CO32
C. HCO3﹣+Ba2++OH﹣→BaCO3↓+H2O
D. 2 HCO3﹣+Ba2++2OH﹣→BaCO3↓+2H2O+CO32﹣
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
下列实验不能达到预期目的是()
A. 用明矾净化饮用水
B. 用过滤的方法除去粗盐中的泥沙
C. 用煤油保存少量的金属钠
D. 用分液的方法分离酒精和水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不正确的是()
①共价化合物中全部为共价键,离子键是阳离子与阴离子之间的相互吸引
②单质分子中可能含有共价键
③H2O2、NH3、HCN分子中都存在三对共用电子对
④CO2和PCl3化学键类型完全相同,且所有原子最外层都达到8电子稳定结构
⑤干冰升华、HCl气体溶于水化学键都没有被破坏
⑥HF的沸点比HCl的沸点高,是由于F的非金属性比Cl强.
A. ①②③⑥ B. ①②④⑤ C. ①③⑤⑥ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关叙述正确的是()
A. 配制一定物质的量浓度的溶液和萃取实验前,都必须检验所用仪器是否漏水
B. 将4 g NaOH溶入准确量取的100 mL水中,可制得浓度为1 mol/L的NaOH溶液
C. 如果不慎将稀盐酸沾到皮肤上,应先用NaOH溶液涂抹,再用水冲洗
D. 最好用蒸馏的方法分离出CCl4和水的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下几个反应:
①Cl2+2KI=2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2FeCl3+2KI=2FeCl2+2KCl+I2
④I2+SO2+2H2O=H2SO4+2HI
判断氧化性由强到弱的顺序是()
A. Cl2>I2>Fe3+>SO2 B. Cl2>Fe3+>I2>SO2
C. Cl2>Fe3+>SO2>I2 D. Fe3+>I2>Cl2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一定体积的HCl气体,将其溶于100mL稀硫酸中,假设溶液的体积不变,向混合溶液中加入4mol•L﹣1的NaOH溶液10mL恰好呈中性.继续向所得中性溶液中滴入过量的Ba(OH)2溶液,所得沉淀质量为2.33g.
(1)生成沉淀的化学方程式为: .
(2)硫酸的物质的量浓度:c(H2SO4)= .
(3)该HCl气体在标准状况下的体积为 mL.
(4)若向该混酸溶液(仍为100mL)中加入Na2CO3•10H2O晶体,直到不再产生气体时为止,消耗Na2CO3•10H2O晶体的质量为 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
烧杯A中盛放0.1mol•L﹣1的H2SO4溶液,烧杯B中盛放0.1mol•L﹣1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法正确的是()
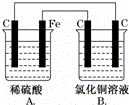
A. A为电解池,B为原电池
B. Fe电极发生还原反应
C. 当A烧杯中产生0.1 mol气体,B烧杯中产生气体也为0.1mol
D. 一段时间后,B烧杯中溶液的浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com