
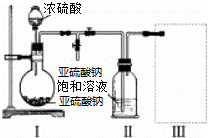
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5
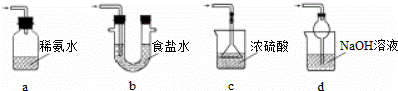
(1)装置Ⅰ中产生气体的化学方程式为 .
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 .
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹时仪器已略去)为 (填序号)
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3.
(4)证明NaHSO3溶液中HSO3﹣的电离程度大于水解程度,可采用的实验方法是 .
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 .
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g•L﹣1.
②在上述实验过程中,若有部分HI被空气氧化,则测定结果 (填“偏高”“偏低”或“不变”).
| 真题集萃;含硫物质的性质及综合应用;探究物质的组成或测量物质的含量;制备实验方案的设计. | |
| 专题: | 实验题;氧族元素. |
| 分析: | (1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水; (2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作; (3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中; (4)NaHSO3溶液中HSO3﹣的电离程度大于水解程度,溶液呈酸性,故检验溶液呈酸性即可; (5)Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可; (6)①由消耗碘的量,结合SO2+I2+2H2O═H2SO4+2HI计算二氧化硫的质量,进而计算浓度; ②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小. |
| 解答: | 解:(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O, 故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O; (2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离, 故答案为:过滤; (3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误; b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误; c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误; d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确; 故答案为:d; (4)NaHSO3溶液中HSO3﹣的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae; 故答案为:ae; (5)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成, 故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成; (6)①令100mL葡萄酒中二氧化硫的质量为mg,则: SO2+2H2O+I2═H2SO4+2HI 64g 1mol mg 0.025L×0.01mol/L 所以,64g:mg=1mol:0.025L×0.01mol/L, 解得m=0.016 故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 故答案为:0.16; ②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低, 故答案为:偏低. |
| 点评: | 本题考查物质的制备实验、实验方案设计、物质含量的测定、氧化还原反应滴定等,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用. |


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:
下列关于配制一定物质的量浓度溶液的说法,正确的组合是( )
①托盘天平可读取到小数点后一位(以“g”为单位)
②托盘天平只能粗略地称量物质的质量,量筒只能粗略地量取液体的体积,严格地说,它们都不能与容量瓶——精确仪器配套使用
③量筒内的残液必须冲洗下来,放入容量瓶中
④称量的固体(或量取的液体)可直接放入容量瓶中溶解(或稀释)
⑤引流时,玻璃棒不能靠在瓶口上
⑥定容摇匀后,若液面低于刻度线,可再次加水补齐
A.①②⑤ B.①③④
C.②④⑥ D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度。制备硼酸的实验流程如下:
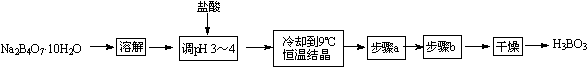 (1)溶解硼砂时需要的玻璃仪器有:烧杯和 ▲ 。
(1)溶解硼砂时需要的玻璃仪器有:烧杯和 ▲ 。
(2)用pH试纸测定溶液pH的操作方法为 ▲ 。
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为 ▲ 。
(4)实验流程中缺少的步骤a、步骤b操作分别为 ▲ 、 ▲ 。
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为: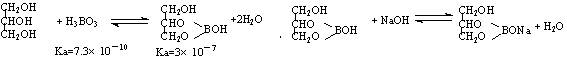 滴定步骤为:
滴定步骤为:
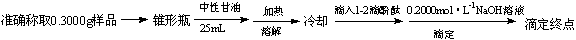 ①滴定到终点时溶液颜色变化是 ▲ 。
①滴定到终点时溶液颜色变化是 ▲ 。
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为 ▲ (假定杂质不反应)。
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果 ▲ (选填:“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化热是指一定条件下,1mol不饱和化合物加氢时放出的热量.表中是环己烯( )、环己二烯(
)、环己二烯( )和苯的氢化热数据:
)和苯的氢化热数据:
| 物质 |
|
|
|
| 氢化热(kJ/mol) | 119.7 | 232.7 | 208.4 |
根据表中数据推断正确的是( )
|
| A. | 环己二烯与H2的反应最剧烈 |
|
| B. | 环己烯、环己二烯和苯有相同的官能团 |
|
| C. | 三种化合物中环己二烯的稳定性最强 |
|
| D. | 上述条件下,1 mo |
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,用含 0.2mol NaOH的溶液恰好吸收0.2mol NO2后得1L溶液,反应的化学方程式为:2NO2+2NaOH→NaNO3+NaNO2+H2O.对反应后的溶液,下列说法正确的是(已知:Ka(HNO2)=7.1×10﹣4、Ka(CH3COOH)=1.7×10﹣5)( )
|
| A. | n(NO2﹣)+n(OH﹣)﹣n(H+)=0.1 mol |
|
| B. | 若通入0.01 mol HCl气体,溶液pH大于2(忽略溶液体积的变化) |
|
| C. | 若加入少量CH3COONa固体,溶液的碱性会减弱 |
|
| D. | 此时溶液的pH大于0.1 mol/L的CH3COONa溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D.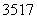 Cl与
Cl与 Cl得电子能力相同
Cl得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能达到实验目的的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
续表
| 选项 | 实验目的 | 实验方案 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,某密闭容器里发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g)正反应为吸热反应,当反应达到平
CO2(g)+H2(g)正反应为吸热反应,当反应达到平 衡时,测得容器中各物质的物质的量均为n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中可采用的是
衡时,测得容器中各物质的物质的量均为n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施中可采用的是
①升高温度 ②增大压强 ③再通入n mol CO2和n mol H2
④再加入2n mol CO和2n mol H2O(g)
A.①② B.②④
C.③④ D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com