
(2)用物质的量都是0.1 mol的CH3COOH和CH3COONa在常温下配成1 L混合溶液,已知其中的c(CH3COO-)>c(Na+),则对该混合溶液的下列判断中正确的是( )
①c(H+)>c(OH-) ②c(CH3COO-)+c(CH3COOH)=0.2 mol·L-1 ③c(CH3COO-)<c(CH3COOH)
④c(CH3COOH)+c(OH-)=0.1 mol·L-1
A.只有② B.①和② C.①②③ D.全部正确
(3)向碳酸钠溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液中碳酸氢根离子浓度变化趋势可能是:
A.逐渐减小 B.逐渐增大 C.先逐渐增大而后减小 D.先逐渐减小而后增大
你的选择是______(填正确选项标号),试用化学方程式和简要文字说明理由__________。
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液,判断:
①溶液中共有_______种粒子(包括分子和离子);
②溶液中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和_________;
③溶液中n(CH3COO-)+n(OH-)-n(H+)=______________mol。
科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
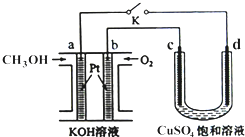 2012年 12 月7日,日本发生7.3级地震,大地震引起的核泄漏阴影再次引起了人们对核能源的恐慌.各国都在寻找替代核能的新型能源,而甲醇是未来重要的绿色能源之一.
2012年 12 月7日,日本发生7.3级地震,大地震引起的核泄漏阴影再次引起了人们对核能源的恐慌.各国都在寻找替代核能的新型能源,而甲醇是未来重要的绿色能源之一.查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+)?c(CH3COO-) | c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| +4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com