
 我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:
我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库.目前,世界各国都在研究如何充分利用海洋资源.全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg•L-1.其工业提取法有:分析 (1)①依据题干叙述可知氯气和溴化钠可以置换出溴单质,其化学化学方程式为:Cl2+2NaBr=2NaCl+Br2;
③溴离子和溴酸根离子用硫酸酸反应,发生氧化还原反应生成单质溴;
(2)溴有氧化性,二氧化硫有还原性,溴与二氧化硫在水溶液中发生氧化还原反应是硫酸和溴化氢;
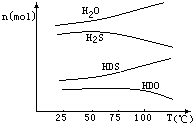
(3)图象分析,物质的量减少的是反应物,增加的是生成物;HDS中的氢原子可以继续与HDO反应,故H2S可循环利用.
解答 解:(1)①依据题干叙述可知氯气和溴化钠可以置换出溴单质,其化学化学方程式为:Cl2+2NaBr=2NaCl+Br2,离子方程式为:Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
②溴离子和溴酸根离子用硫酸酸反应,发生氧化还原反应生成单质溴,反应的离子方程式为:BrO3--+5Br-+6H+═3Br2+3H2O,
故答案为:BrO3-+5Br-+6H+═3Br2+3H2O;
(2)溴有氧化性,二氧化硫有还原性,在水溶液里,二氧化硫和溴发生氧化还原反应生成硫酸和氢溴酸,反应的离子方程式为:Br2+SO2+2H2O=H2SO4+2HBr,
故答案为:Br2+SO2+2H2O=H2SO4+2HBr;
(3)物质的量减少的是反应物,增加的是生成物,反应物为H2S,HDO,生成物为HDS,H2O;HDS中的氢原子可以继续与HDO反应,故H2S可循环利用,
故答案为:H2S+HDO=HDS+H2O; H2S.
点评 本题考查海水资源的提取原理、氧化还原反应等知识,注意离子方程式书写,掌握基础,仔细审题是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙二醇属于同系物 | |
| B. | 1-丁烯存在顺反异构体 | |
| C. | 将苯加入溴水中,溴水褪色,是因为发生了加成反应 | |
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,A分子内含有的官能团是(填名称)醛基.
,A分子内含有的官能团是(填名称)醛基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=Z-n | B. | 所含中子数=A-Z+n | ||
| C. | 质量数=A+n | D. | 所含电子数=Z+n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都能与金属钠反应 | |
| B. | 用氢氧化钠除去乙酸乙酯中的少量乙酸 | |
| C. | 植物油和动物脂肪都不能使溴水褪色 | |
| D. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(H+) 减小 | B. | c(OH-) 与 c(H+) 的乘积增大 | ||
| C. | c(H+ ) 减小 | D. | c(OH-) 增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com