
| 1.297×10-2g |
| 0.0005mol |


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于
(1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
| ①能使溴的四氯化碳溶液褪色 ②比例模型为 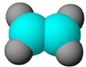 ③组成该有机物的两元素质量比为6:1 | ①由C、H两种元素组成 ②球棍模型为  | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与D反应生成相对分子质量为130的酯F | ①由C、H、O三种元素组成 ②球棍模型为 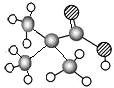 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 现象及结论 |
| 取适量晶体于烧瓶中,加入足量3mol?L-1H2SO4,塞上带导气管的橡皮塞,将产生的气体导出并依次通过盛有 | 则晶体中含Na2CO3杂质. |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应编号 | 反应物质 | 有关现象 |
| ① | A+B | 有沉淀生成 |
| ② | B+C | 有气体放出 |
| ③ | C+D | 有沉淀生成 |
| ④ | B+D | 无明显现象 |
| ⑤ | A+D | 有沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com