
分析 (1)碱或强碱弱酸盐其溶液都呈碱性;
(2)pH=-lgc(H+);醋酸钠促进水电离,根据氢离子浓度结合水的离子积常数计算氢氧根离子浓度;
(3)醋酸根离子在溶液中水解生成氢氧根离子,溶液显碱性;
(4)醋酸是弱电解质,氯化氢是强电解质,醋酸存在电离平衡,氯化氢不存在电离平衡,将等pH的醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸稀释的倍数大于盐酸.
解答 解:(1)碱或强碱弱酸盐其溶液都呈碱性,氢氧化钠和氨水、醋酸钠溶液都呈碱性,
故答案为:②④⑤;
(2)pH=-lgc(H+)=-lg0.01=2,醋酸钠促进水电离,醋酸钠溶液中氢离子浓度为10-11mol/L,根据水的离子积常数知,氢氧根离子浓度等于10-3 mol/L,
故答案为:2;10-3 mol/L;
(3)醋酸根离子在溶液中水解生成氢氧根离子,溶液显碱性,其水解离子方程式为:CH3COO-+H2O?CH3COOH+OH-;
故答案为:CH3COO-+H2O?CH3COOH+OH-;
(4)醋酸是弱电解质,氯化氢是强电解质,稀释会促进醋酸的电离,若将醋酸和盐酸稀释相同的倍数,醋酸的pH会比盐酸小,因此若要使醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸要稀释的倍数要更大一点才能满足要求,
故答案为:小于.
点评 本题考查了弱电解质的电离、酸碱混合溶液定性判断等知识点,根据弱电解质电离特点及酸碱中和反应来分析解答,明确物质的性质是解本题关键,再结合基本概念、pH的计算、物料守恒等知识点分析,题目难度中等.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,c(NH4+)大小顺序为:③>②>① | |
| C. | 等体积,等物质的量浓度的Na2S溶液与NaHS溶液混合后:3c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 等体积、等物质的量浓度的Na2SO3溶液与HCl溶液混合后:c(H+)+c(H2SO3)═c(SO32-)++c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
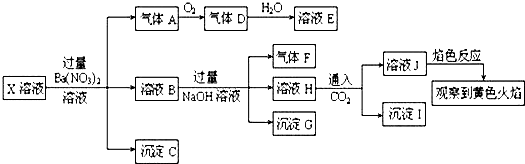
| A. | X中不能确定的离子是Fe3+、A13+、K+、Na+和C1- | |
| B. | 沉淀G中加入盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| D. | 沉淀I一定是A1(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
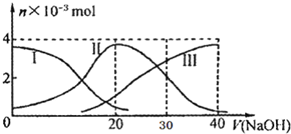 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )| A. | H2A在水中的电离方程式是:H2A═H++HA-;HA-═H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小 | |
| D. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2 c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在NH4Cl溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时立即用沙子盖灭 | |
| B. | 将过期的化学药品直接倒入下水道 | |
| C. | 少量浓硫酸溅到皮肤上立即用大量水冲洗 | |
| D. | 用肥皂液涂在天然气管道接口处检验是否漏气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com