
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
分析 (1)①△G=△H-T△S<0时,反应自发进行;
(2)①根据v=$\frac{△c}{△t}$计算v(CO),再利用速率之比等于化学计量数之比计算v(CO2);一氧化碳的转化率为$\frac{一氧化碳的变化量}{一氧化碳的起始量}×100%$:根据三行式计算平衡时各组的物质的量浓度,然后代入平衡常数表达式求解;
②第2组可以等效为:开始在650℃时加入1molH2O、2molCO到达平衡,保持温度不变,再加入1molCO达到平衡,最后再升高温度到900℃时到达平衡;开始在650℃时加入1molH2O、2molCO到达平衡,与第1组为等效平衡,转化率相同,平衡时H2为0.8mol,保持温度不变,再加入1molCO达到平衡,平衡正向移动,平衡时H2物质的量大于0.8mol,升高温度到900℃时到达平衡,氢气的物质的量减小,说明升高温度平衡向逆反应方向移动;
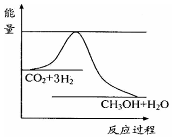
(3)根据图象知,该反应的正反应是放热反应,能使c(CH3OH)增大,说明平衡向正反应方向移动.
解答 解:(1)①该反应△H>0,△S>0,△G=△H-T△S<0时,反应自发进行,故高温下反应可以自发进行,故答案为:温度;
(2)①v(CO)=$\frac{\frac{4mol-2.4mol}{2L}}{5min}$=0.16mol•(L•min)-1,速率之比等于化学计量数之,则v(CO2)=0.16mol•(L•min)-1,
CO(g)+H2O(g)?CO2(g)+H2(g),
c(初):1 0.5 0 0
c(变):0.2 0.2 0.2 0.2
c(平):0.8 0.3 0.2 0.2
K=$\frac{C(C{O}_{2})C({H}_{2})}{C(CO)C({H}_{2}O)}$=$\frac{0.2×0.2}{0.8×0.3}$=0.17
故答案为:0.16mol•(L•min)-1;0.17;
②第2组可以等效为:开始在650℃时加入1molH2O、2molCO到达平衡,保持温度不变,再加入1molCO达到平衡,最后再升高温度到900℃时到达平衡;开始在650℃时加入1molH2O、2molCO到达平衡,与第1组为等效平衡,转化率相同,平衡时H2为0.8mol,保持温度不变,再加入1molCO达到平衡,平衡正向移动,平衡时H2物质的量大于0.8mol,升高温度到900℃时到达平衡,氢气的物质的量减小,说明升高温度平衡向逆反应方向移动,故逆反应为吸热反应,
故答案为:吸热;
(3)a.升高温度,平衡逆向移动,c(CH3OH)减小,故a错误;
b.充入He(g),使体系压强增大,由于容器为恒容容器,各组分浓度不变,平衡不移动,c(CH3OH)不变,故b错误;
c.将H2O(g)从体系中分离出来,平衡正向移动,c(CH3OH)增大,故c正确;
d.再充入1mol CO2和3molH2,平衡正向移动,c(CH3OH)增大,故d正确.
故答案为:cd.
点评 本题考查化学平衡有关计算、平衡状态判断、反应自发性等,注意掌握化学平衡常数的应用,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
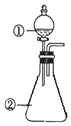 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 亚硫酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
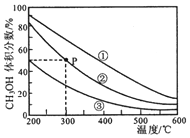
| A. | 该反应的正反应为放热反应 | |
| B. | 三个容器容积:①>②>③ | |
| C. | 在P点,CO转化率为75% | |
| D. | 在P点,向容器②中再充入CO、H2 及 CH3OH 各 0.025mol,此时 v(CO)正<v (CO)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 负极的电极反应式为Mg+2OH-+2e-═Mg(OH)2 | |
| B. | 电池放电时,OH-向负极移动 | |
| C. | 电解质溶液可以是稀H2SO4 | |
| D. | 正极的电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com