
实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ②固定铁圈位置③放上蒸发皿 ④加热搅拌 ⑤停止加热、余热蒸干 其正确的操作顺序为
A. ②③④⑤ B. ①②③④⑤ C. ②③①④⑤ D. ②①③④⑤
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
向含有c(FeCl3)=0.3 mol·L-1、c(FeCl2)=0.15 mol·L-1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是 直径约为9.3 nm的金属氧化物,下列有关说法中正确的是( )
直径约为9.3 nm的金属氧化物,下列有关说法中正确的是( )
A.该分散系的分散质为Fe2O3
B.在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷
C.可用过滤的方法将黑色金属氧化物与Na+分离开
D.加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-===Fe3O4+4H2O
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:选择题
利用下列实验装置能完成对应实验的是

A. 量取20.00mLNa2CO3溶液 B. 能证明非金属性Cl>C>Si
C. 实验室制取并收集NH3 D. 分离酒精与CCl4
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期期中化学试卷(解析版) 题型:推断题
【化学—有机化学基础】从薄荷油中得到一种烃A(C10H16),与A相关反应如下:
(1)H的分子式为 。
(2)B所含官能团的名称为 。
(3)含两个—COOCH3基团的C的同分异构体共有 种(不考虑手性异构),其中核磁共振氢谱呈现2个吸收峰的异构体结构简式为 。
(4)D→E的反应类型为 。
(5)G为含六元环的化合物 ,写出其结构简式: 。
,写出其结构简式: 。
(6)写出E→F的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期期中化学试卷(解析版) 题型:选择题
某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是
A.Zn极发生的反应是还原反应
B.正极反应式为2Fe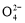 +
+ =Fe2O3+5H2O
=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时 向负极迁移
向负极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$
 .
. .
. ;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应.
;H是另一种副产物,它 是一种高分子化合物,形成这种物质的反应类型为缩聚反应. (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度:a>b,且a点所示溶液中由水电离出的c(OH-)=10-8.7mol/L | |
| C. | pH=7时溶液中c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-) | |
| D. | b点所示溶液中c(A-)>c(HA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com