
【题目】在两个容积均为![]() 的恒容密闭容器中,起始时均充入
的恒容密闭容器中,起始时均充入![]() ,以温度、
,以温度、![]() 催化剂为实验条件变量,进行
催化剂为实验条件变量,进行![]() 的分解实验
的分解实验![]() 反应为
反应为![]() 。测得的结果如图所示。
。测得的结果如图所示。![]() 曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时
曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时![]() 的转化率
的转化率![]()
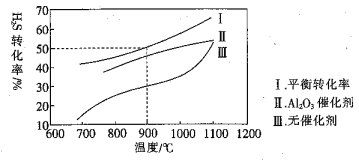
下列说法正确的是( )
A.温度升高,![]() 分解的速率增大,
分解的速率增大,![]() 的含量减少
的含量减少
B.由曲线Ⅱ、Ⅲ可知,加入![]() 可提高
可提高![]() 的平衡转化率
的平衡转化率
C.![]() 时,ts后达到平衡,则
时,ts后达到平衡,则![]() 的生成速率为
的生成速率为![]()
D.约![]() 时,曲线Ⅱ、Ⅲ几乎重合,说明
时,曲线Ⅱ、Ⅲ几乎重合,说明![]() 可能几乎失去催化活性
可能几乎失去催化活性
科目:高中化学 来源: 题型:
【题目】图中A为淡黄色固体,B的阳离子与A相同(其他物质均略去).
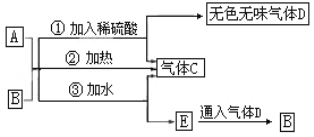
根据以上关系,回答下列问题:
(1)A的电子式为__________.
(2)A投入FeCl2溶液中的反应为_______________(请用一个化学方程式表示)
(3)若A、B按物质的量之比1:1.5混合在密闭容器中加热充分反应后,排出气体,则剩余的固体为_____________________________(写化学式)
(4)氢能被视为21世纪最具发展潜力的清洁能源,试回答下列问题:
①与化石燃料相比,氢气作为燃料的优点是__________________(答两点)。
②施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气,写出NaBH4与水反应的化学方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G具有镇痛、消炎等药理作用,其合成路线如下:

(1)E中官能团的名称为____、____。
(2)B→C、E→F的反应类型分别为____、____。
(3)M的结构简式为____。
(4)写出同时满足下列条件的C的一种同分异构体的结构简式:____。
Ⅰ.既能发生银镜反应,也能发生水解反应;
Ⅱ.与NaOH溶液共热后所得产物之一含三种化学环境不同的氢,且能与金属钠反应。
(5)请写出以乙烯、丙烯和PPh3为原料制备(CH3)2C=CH-CH=C(CH3)2的合成路线流程图(无机试剂任用,合成路线流程图例见本题题干)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向
时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() ,反应
,反应![]() 经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是
经过一段时间后达到平衡,反应过程中测定的部分数据如图所示。下列说法正确的是![]()
![]()
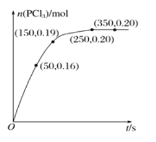
A.反应在前50s的平均速率![]()
![]()
B.相同温度下,起始时向容器中充入![]() mol
mol![]() 和
和![]() mol
mol![]() ,达到平衡时,
,达到平衡时,![]() 的转化率小于
的转化率小于![]()
C.![]() 时,该反应的化学平衡常数
时,该反应的化学平衡常数![]()
D.相同温度下,起始时向容器中充入![]() mol
mol![]() 、
、![]() mol
mol![]() 和
和![]() mol
mol![]() ,反应达到平衡前
,反应达到平衡前![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在调节好pH和![]() 浓度的废水中加
浓度的废水中加![]() ,能氧化降解污染物。现用该方法降解污染物
,能氧化降解污染物。现用该方法降解污染物![]() ,控制
,控制![]() 、
、![]() 和
和![]() 的初始浓度相同,设计如下对比实验探究温度、pH对该降解反应速率的影响,测得
的初始浓度相同,设计如下对比实验探究温度、pH对该降解反应速率的影响,测得![]() 的浓度随时间变化的关系如下图。
的浓度随时间变化的关系如下图。
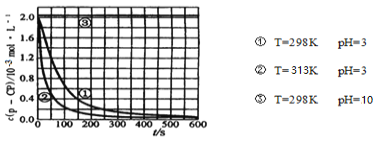
下列结论或推断不正确的是
A.实验①、②表明适当升高温度,降解反应速率增大
B.根据反应原理推断,温度过高,反而会使降解速率变慢
C.313K、![]() 时,在
时,在![]() 内,
内,![]() 的分解平均速率约为
的分解平均速率约为![]() mol/(L·s)
mol/(L·s)
D.室温下,实验过程中取样分析浓度可以采用迅速加碱调节溶液pH的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积固定为2L的密闭容器中充入![]() 和
和![]() ,发生如下反应:①
,发生如下反应:①![]()
![]() ②
②![]() 测得
测得![]() 和
和![]() 的浓度变化如图所示,
的浓度变化如图所示,![]() 维持容器温度为
维持容器温度为![]() ,10min时改变某反应条件,一段时间后再次平衡。下列说法正确的是
,10min时改变某反应条件,一段时间后再次平衡。下列说法正确的是![]()
![]()
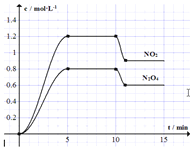
A.前5min反应的平均速率![]()
B.![]() 时反应①的化学平衡常数
时反应①的化学平衡常数![]()
C.10min时改变反应条件可能是降低温度
D.若起始时向该容器中充入![]() 和
和![]() ,
,![]() 达到平衡时,
达到平衡时,![]() 的物质的量浓度与图中
的物质的量浓度与图中![]() 的不同
的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+Y(g)![]() nZ(g) ΔH <0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如图。下列说法正确的是( )
nZ(g) ΔH <0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如图。下列说法正确的是( )

A.反应方程式中n=2
B.该反应的ΔS>0
C.10 min时,曲线发生变化的原因是增大压强
D.0~5min内,平均反应速率v(X)=0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有甲、乙两种物质:甲![]() 、乙
、乙![]() 。由甲转化为乙需经下列过程
。由甲转化为乙需经下列过程![]() 已略去各步反应的无关产物,下同
已略去各步反应的无关产物,下同![]()
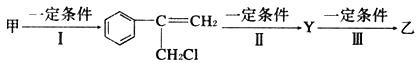
①反应I的反应类型是__________,反应II的条件是___________,反应III的化学方程式为_________________________
②下列物质不能与乙反应的是_________![]() 填序号
填序号![]() 。
。
![]() 金属钠
金属钠 ![]() 溴水
溴水 ![]() 氢氧化钠溶液
氢氧化钠溶液 ![]() 乙酸
乙酸
(2)写出苯酚和碳酸钠溶液反应的离子方程式__________________。
(3)写出乙醛和银氨溶液反应的化学方程式____________________。
(4)写出乙二酸和钠反应的化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
具有自主知识产权、中国制造的C919,是一款与波音737MAX同等体量的民用飞机。制造C919需要大量的合金材料,其中包括钢,钢是现代社会的物质基础,钢中除含有铁外还含有碳和少量不可避免的硅、锰、磷、硫等元素。请回答下列有关问题:

(1)基态Mn2+的价电子排布图为___________。
(2)NO2的立体构型名称为___________,其中心原子的杂化方式为___________。
(3)写出和CN-互为等电子体的一种分子的电子式___________。
(4)铵盐大多易分解,NH4F和NH4Br两种盐中较难分解的是______(填化学式);理由是_______。
(5) 氧化亚铁晶胞与NaC1的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为apm,该晶体的密度ρ=___________________ g·cm-3 (列出计算式即可,用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com