
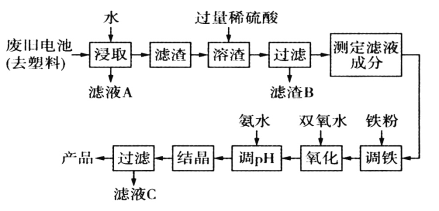
”¾ĢāÄæ”æ¼īŠŌŠæĆĢµē³ŲµÄ¹¤×÷ŌĄķ:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,ĘäÖŠµÄµē½āÖŹČÜŅŗŹĒKOHČÜŅŗ”£Ä³æĪĢā×éÓĆ·Ļ¾ÉĢśæĒĪŽ¹Æ¼īŠŌŠæĆĢµē³ŲĪŖŌĮĻ,ÖʱøŅ»ÖÖŠĀŠĶ²ÄĮĻMnxZn(1-x)Fe2O4,Ę乤ŅÕĮ÷³ĢČēĶ¼ĖłŹ¾:
(1)ĀĖŅŗAÖŠČÜÖŹµÄµē×ÓŹ½ĪŖ____________”£
(2)ŅŃÖŖMnxZn(1-x)Fe2O4ÖŠĆĢŌŖĖŲµÄ»ÆŗĻ¼ŪÓėŹµŃéŹŅÓƶžŃõ»ÆĆĢÖĘČ”ĀČĘųŹ±»¹Ō²śĪļÖŠĆĢŌŖĖŲµÄ»ÆŗĻ¼ŪĻąĶ¬£¬ŌņĢśŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ_________”£
(3)”°ČÜŌü”±¹¤ŠņÖŠĻ”ĮņĖįÓėĢś·“Ӧɜ³ÉµÄĮņĖįŃĒĢśæɽ«+3¼ŪĆĢµÄ»ÆŗĻĪļČ«²æ»¹Ō³ÉMn2+£¬Š“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½:_____________________________”£
(4)”°µ÷Ģś”±¹¤ŠņµÄÄæµÄŹĒµ÷ÕūĀĖŅŗÖŠĢśĄė×ÓµÄ×ÜÅØ¶Č£¬Ź¹ĘäÖŠ½šŹōŌŖĖŲµÄĪļÖŹµÄĮæÖ®±ČÓė²śĘ·µÄ»ÆѧŹ½MnxZn(1-X)Fe2O4Ļą·ūŗĻ”£
¢ŁŠ“³ö”°µ÷Ģś"¹¤ŠņÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½:_________________,___________________”£
¢ŚČō²āµĆĀĖŅŗµÄ³É·ÖĪŖc(Mn2+)+c(Zn2+)=amol.L-1,c(Fe2+)+c(Fe3+)=bmol.L-1£¬ĀĖŅŗĢå»żĪŖ1m3,”°µ÷Ģś”±¹¤ŠņÖŠ£¬Šč¼ÓČėµÄĢś·ŪÖŹĮæĪŖ________kg(ŗöĀŌČÜŅŗĢå»ż±ä»Æ£¬ÓĆŗ¬a”¢bµÄ“śŹżŹ½±ķŹ¾)”£
(5)ŌŚ”°Ńõ»Æ"¹¤ŠņÖŠ£¬¼ÓČėĖ«ŃõĖ®µÄÄæµÄŹĒ°ŃFe2+Ńõ»ÆĪŖFe3+;Éś²ś¹ż³ĢÖŠ·¢ĻÖŹµ¼ŹĻūŗÄĖ«ŃõĖ®µÄĮæ“óÓŚĄķĀŪÖµ,ĘäæÉÄÜŌŅņ³żĪĀ¶ČĶā£¬Ö÷ŅŖŹĒ_______________”£
(6)ÓĆ°±Ė®”°µ÷pH"ŗó,¾”°½į¾§”±”°¹żĀĖ”±æɵƵ½²śĘ·ŗĶĀĖŅŗC,“ÓĀĖŅŗCÖŠ»¹æÉ·ÖĄė³öŅ»ÖÖµŖ·Ź£¬øƵŖ·ŹµÄČÜŅŗÖŠµÄĄė×ÓÅضČÓÉŠ”µ½“óµÄĖ³ŠņĪŖ_____________________”£
”¾“š°ø”æ![]() +3 MnO(OH)+Fe2++3H+=Mn2++Fe3++2H2O Fe+2Fe3+=3Fe2+ Fe+2H+=Fe2++H2”ü 112a-56b Éś³ÉµÄFe3+“ß»ÆĮĖĖ«ŃõĖ®µÄ·Ö½ā (OH-)£¼c(H+)£¼c(SO42-)£¼c(NH4+)
+3 MnO(OH)+Fe2++3H+=Mn2++Fe3++2H2O Fe+2Fe3+=3Fe2+ Fe+2H+=Fe2++H2”ü 112a-56b Éś³ÉµÄFe3+“ß»ÆĮĖĖ«ŃõĖ®µÄ·Ö½ā (OH-)£¼c(H+)£¼c(SO42-)£¼c(NH4+)
”¾½āĪö”æ
·Ļ¾ÉĪŽ¹Æ¼īŠŌŠæĆĢµē³ŲĪŖŌĮĻ£¬ÖʱøŅ»ÖÖŠĀŠĶ²ÄĮĻMnxZn(1-x)Fe2O4£¬·Ļ¾Éµē³Ų¼ÓČėĖ®½žČ”¹żĀĖµĆµ½ĀĖŅŗAŗĶĀĖŌü£¬ĀĖŌü¼ÓČė¹żĮæĻ”ĮņĖįČŪŌüŗó¼ÓČėĢś£¬Ļ”ĮņĖįÓėĢś·“Ӧɜ³ÉµÄĮņĖįŃĒĢśæɽ«+3¼ŪĆĢµÄ»ÆŗĻĪļČ«²æ»¹Ō³ÉMn2+£¬¹żĀĖµĆµ½ĀĖŌüBŗĶĀĖŅŗ£¬²ā¶ØĀĖŅŗ³É·Ö£¬”°µ÷Ģś”±¹¤ŠņµÄÄæµÄŹĒµ÷ÕūČÜŅŗÖŠĢśĄė×ÓµÄ×ÜÅØ¶Č£¬Ź¹ĘäÖŠ½šŹōŌŖĖŲµÄĪļÖŹµÄĮæÖ®±ČÓė²śĘ·µÄ»ÆѧŹ½MnxZn(1-x)Fe2O4Ļą·ūŗĻ£¬¼ÓČė¹żŃõ»ÆĒāŃõ»ÆŃĒĢśĄė×ÓÉś³ÉĢśĄė×Ó£¬ÓĆ°±Ė®”°µ÷pH”±ŗ󣬾”°½į¾§”±”°¹żĀĖ”±æɵƵ½²śĘ·ŗĶĀĖŅŗC£¬“ÓĀĖŅŗCÖŠ»¹æÉ·ÖĄė³öŅ»ÖÖµŖ·ŹĪŖĮņĖįļ§£¬¾Ż“Ė½ā“š”£
(1)ĀĖŅŗAÖŠČÜÖŹŹĒKOH£¬ŗ¬ÓŠĄė×Ó¼üŗĶ¹²¼Ū¼ü£¬µē×ÓŹ½ĪŖ![]() ”£
ӣ
(2)ŅŃÖŖMnxZn(1-x)Fe2O4ÖŠĆĢŌŖĖŲµÄ»ÆŗĻ¼ŪÓėŹµŃéŹŅÓƶžŃõ»ÆĆĢÖĘČ”ĀČĘųŹ±µÄ»¹Ō²śĪļÖŠµÄĆĢµÄ»ÆŗĻ¼ŪĻąĶ¬£¬æÉÖŖMnĪŖ+2¼Ū£¬Šæ+2¼Ū”¢ŃõŌŖĖŲ-2¼Ū£¬Ōņøł¾Ż»ÆŗĻ¼Ū“śŹżŗĶĪŖ0æÉÖŖĢśŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ+3£»
(3)”°ČÜŌü”±¹¤ŠņÖŠĻ”ĮņĖįÓėĢś·“Ӧɜ³ÉµÄĮņĖįŃĒĢśæɽ«+3¼ŪĆĢµÄ»ÆŗĻĪļČ«²æ»¹Ō³ÉMn2+£¬øĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖMnO(OH)+Fe2++3H+=Mn2++Fe3++2H2O”£
(4)¢Ł”°µ÷Ģś"¹¤ŠņÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖFe+2Fe3+=3Fe2+”¢Fe+2H+=Fe2++H2”ü”£
¢Śn£ØMn2+£©+n£ØZn2+£©=a molL-1”Į1000L=1000amol£¬ŅŃÓŠĢśŌŖĖŲbmol/L”Į1000L=1000bmol£¬ÓɵēŗÉŹŲŗćæÉÖŖMnxZn(1-x)Fe204ÖŠŗ¬Fe2O42-ĪŖ1000amol£¬ĘäÖŠĢśŌŖĖŲµÄĪļÖŹµÄĮæĪŖ1000amol”Į2=2000amol£¬»¹Šč¼ÓČėĢśµÄĪļÖŹµÄĮæĪŖ2000amol-1000bmol£¬ÖŹĮæĪŖ£Ø2000amol-1000bmol£©mol”Į56g/mol=£Ø112a-56b£©kg”£
(5)ŌŚ”°Ńõ»Æ"¹¤ŠņÖŠ£¬¼ÓČėĖ«ŃõĖ®µÄÄæµÄŹĒ°ŃFe2+Ńõ»ÆĪŖFe3+£¬Éś²ś¹ż³ĢÖŠ·¢ĻÖŹµ¼ŹĻūŗÄĖ«ŃõĖ®µÄĮæ“óÓŚĄķĀŪÖµ£¬ĘäæÉÄÜŌŅņ³żĪĀ¶ČĶā£¬Ö÷ŅŖŹĒÉś³ÉµÄFe3+“ß»ÆĮĖĖ«ŃõĖ®µÄ·Ö½ā”£
(6)ÓĆ°±Ė®”°µ÷pH”±ŗ󣬾”°½į¾§”±”°¹żĀĖ”±æɵƵ½²śĘ·ŗĶĀĖŅŗC£¬“ÓĀĖŅŗCÖŠ»¹æÉ·ÖĄė³öŅ»ÖÖµŖ·ŹĪŖĮņĖįļ§£¬ļ§øłĄė×ÓĖ®½āČÜŅŗĻŌĖįŠŌ£¬Ąė×ÓÅضČĪŖc(OH-)£¼c(H+)£¼c(SO42-)£¼c(NH4+)”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŹŅĪĀĻĀ£¬ŌŚ20 mLŠĀÖĘĀČĖ®ÖŠµĪ¼ÓpH=13µÄNaOHČÜŅŗ£¬ČÜŅŗÖŠĖ®µēĄėµÄc(H)Óė NaOHČÜŅŗĢå»żµÄ¹ŲĻµČēĶ¼ĖłŹ¾”£ŅŃÖŖ£ŗK(HClO)=3”Į108£¬H2CO3£ŗKa1=4.3”Į107£¬Ka2=5.6”Į1011”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
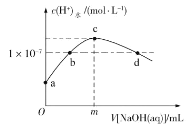
A.mŅ»¶ØµČÓŚ20
B.b”¢dµć¶ŌÓ¦µÄČÜŅŗĻŌÖŠŠŌ
C.cµćČÜŅŗÖŠc(Na)=2c(ClO)+2c(HClO)
D.ĻņcµćČÜŅŗÖŠĶØČėÉŁĮæCO2£ŗ2ClO+H2O+CO2=2HClO+CO32
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ¾ŪŗĻĮņĖįĢśæÉÓĆÓŚĖ®µÄ¾»»Æ£¬»ÆѧŹ½æɱķŹ¾ĪŖ[Fea(OH)b(SO4)c]m£¬Č”ĘäÓė×ćĮæŃĪĖį·“Ó¦£¬ĖłµĆČÜŅŗĘ½¾ł·ÖĪŖĮ½·Ż£¬Ņ»·ŻČÜŅŗ¼ÓČė×ćĮæµÄBaCl2ČÜŅŗ£¬µĆµ½³Įµķ4.66 g”£ĮķŅ»·ŻČÜŅŗ£¬¼ÓČė×ćĮæµÄNaOHČÜŅŗŗó¹żĀĖ£¬¶ŌĀĖ³ö¹ĢĢåĻ“µÓ£¬ŗó×ĘÉÕµĆµ½ŗģ×ŲÉ«¹ĢĢåÖŹĮæĪŖ1.6 g£¬øĆ¾ŪŗĻĮņĖįĢśŃłĘ·ÖŠa”ĆbµÄ±ČÖµŹĒ
A. 1”Ć1B. 2”Ć1C. 3”Ć1D. 2”Ć5
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ»ś·“Ó¦²»ŹōÓŚČ”“ś·“Ó¦µÄŹĒ
A. C2H5OH + CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
B. H©C”ŌC©H + HCl![]() H2C=CHCl
H2C=CHCl
C. ![]() + HNO3
+ HNO3![]()
![]() +H2O
+H2O
D. ![]() + Br2
+ Br2![]()
![]() +HBr
+HBr
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓŠ¹ŲĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£AŹĒÉśŹÆ»ŅµÄÖ÷ŅŖ³É·Ö£¬BŹĒŅ»ÖÖ¾ßÓŠĘư׊ŌµÄĪŽÉ«ĘųĢ壬DŹĒŅ»ÖÖ³£¼ūµÄĪŽÉ«ŅŗĢ壬FŹĒijÖÖ²¹ŃŖ¼ĮµÄÓŠŠ§³É·Ö£¬GŹĒŅ»ÖÖ³£¼ūµÄĒæĖį£¬HµÄĦ¶ūÖŹĮæĪŖ72 g”¤mol£1”£

£Ø1£©AµÄ»ÆѧŹ½ĪŖ____________”£
£Ø2£©DµÄµē×ÓŹ½ĪŖ____________”£
£Ø3£©Š“³ö·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½£ŗ________________________”£
£Ø4£©Š“³ö·“Ó¦¢ŚµÄĄė×Ó·½³ĢŹ½£ŗ________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆĄĶŠĀå¶ū(H)ŹōÓŚŅ»Ļß½µŃ¹Ņ©£¬ŹĒµ±Ē°ÖĪĮĘøßŃŖŃ¹”¢¹ŚŠÄ²””¢ŠÄ½ŹĶ“”¢ĀżŠŌŠÄĮ¦Ė„½ßµČŠÄŃŖ¹Ü¼²²”µÄ³£ÓĆŅ©ĪļÖ®Ņ»”£ĖüµÄŅ»ÖÖŗĻ³ÉĀ·ĻßČēĻĀ:
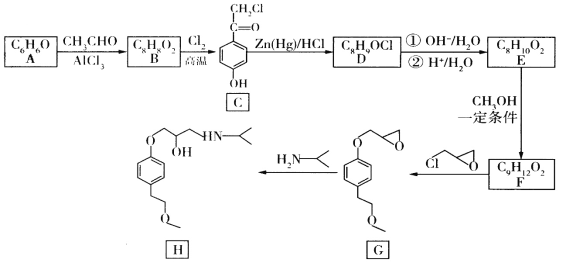
ŅŃÖŖ:CH3COCH2R![]() CH3CH2CH2R”£
CH3CH2CH2Rӣ
(1)AĪļÖŹ»ÆѧĆū³ĘŹĒ_________”£
(2)·“Ó¦B”śCµÄ»Æѧ·½³ĢŹ½ĪŖ_________________;C”śDµÄ·“Ó¦ĄąŠĶĪŖ________”£
(3)DÖŠĖłŗ¬¹ŁÄÜĶŵÄĆū³ĘŹĒ______________”£
(4)GµÄ·Ö×ÓŹ½ĪŖ________;ŅŃÖŖĢ¼Ō×ÓÉĻĮ¬ÓŠ4øö²»Ķ¬µÄŌ×Ó»ņ»łĶÅŹ±£¬øĆĢ¼Ō×Ó³ĘĪŖŹÖŠŌĢ¼Ō×Ó£¬ŌņH(ĆĄĶŠĀå¶ū)ÖŠŗ¬ÓŠ________øöŹÖŠŌĢ¼Ō×Ó”£
(5)·¼Ļć×å»ÆŗĻĪļXÓėC»„ĪŖĶ¬·ÖŅģ¹¹Ģ唣Š“³öĶ¬Ź±Āś×ćĻĀĮŠĢõ¼žµÄXµÄŅ»ÖÖ½į¹¹¼ņŹ½___________”£
¢ŁÄÜ·¢ÉśŅų¾µ·“Ó¦;
¢Ś²»ÓėFeCl3·¢ÉśĻŌÉ«·“Ó¦;
¢Ūŗ¬"C-Cl”±¼ü;
¢ÜŗĖ“Ź²ÕńĒāĘ×ÓŠ4øö·å£¬·åĆ껿±ČĪŖ2:2:2:1”£
(6)4-ÜŠ»ł±½·Ó(![]() )ŹĒŅ»ÖÖŅ©ĪļÖŠ¼äĢ壬ĒėÉč¼ĘŅŌ±½¼×“¼ŗĶ±½·ÓĪŖŌĮĻÖʱø4»ł±½·ÓµÄŗĻ³ÉĀ·Ļß:__________(ĪŽ»śŹŌ¼ĮČĪŃ”)”£
)ŹĒŅ»ÖÖŅ©ĪļÖŠ¼äĢ壬ĒėÉč¼ĘŅŌ±½¼×“¼ŗĶ±½·ÓĪŖŌĮĻÖʱø4»ł±½·ÓµÄŗĻ³ÉĀ·Ļß:__________(ĪŽ»śŹŌ¼ĮČĪŃ”)”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹµŃé²Ł×÷”¢ĻÖĻó¼°½įĀŪ¾łÕżČ·µÄŹĒ
Ń”Ļī | ŹµŃé²Ł×÷ŗĶĻÖĻó | ŹµŃé½įĀŪ |
A | Ļņij»ĘÉ«ČÜŅŗÖŠ¼ÓČėµķ·ŪKIČÜŅŗ£¬ČÜŅŗ³ŹĄ¶É« | »ĘÉ«ČÜŅŗÖŠÖ»ŗ¬Br2 |
B | Éձ֊擼ū°×É«³Įµķ | Ö¤Ć÷ĖįŠŌĒæČõ£ŗH2CO3>H2SiO3 |
C | Ļņ20%ÕįĢĒČÜŅŗÖŠ¼ÓČėÉŁĮæĻ”H2SO4£¬¼ÓČČ£»ŌŁ¼ÓČėŅų°±ČÜŅŗ£»Ī“³öĻÖŅų¾µ | ÕįĢĒĪ“Ė®½ā |
D | pHŹŌÖ½ĻȱäŗģŗóĶŹÉ« | ĀČĖ®¼ČÓŠĖįŠŌ£¬ÓÖÓŠĘư׊Ō |
A.AB.BC.CD.D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĆĄ¹śŅ©Īļѧ¼Ņ×ī½üŗĻ³ÉŅ»ÖÖæÉÄÜÓĆÓŚÖĪĮĘøßŃŖŃ¹µÄÓŠ»śĪļK£¬ŗĻ³ÉĀ·ĻßČēĻĀ£ŗ
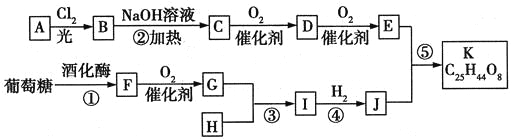
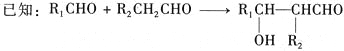
ĘäÖŠAŹōÓŚĢ¼Ēā»ÆŗĻĪļ£¬ĘäÖŠĢ¼µÄÖŹĮæ·ÖŹżŌ¼ĪŖ83.3%£»EµÄŗĖ“Ź²ÕńĒāĘ×ÖŠÖ»ÓŠ2×éĪüŹÕ·å”£H³£ĪĀĻĀ³ŹĘųĢ¬£¬ŹĒŹŅÄŚ×°äź²śÉśµÄÖ÷ŅŖĪŪČ¾ĪļÖ®Ņ»”£GŗĶHŅŌ1£ŗ3·“Ӧɜ³ÉI”£
ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©AµÄ·Ö×ÓŹ½ĪŖ£ŗ______________”£
£Ø2£©Š“³öĻĀĮŠĪļÖŹµÄ½į¹¹¼ņŹ½£ŗD£ŗ____________£»G£ŗ___________”£
£Ø3£©·“Ó¦¢ŁØD¢ŻÖŠŹōÓŚČ”“ś·“Ó¦µÄÓŠ___________”£
£Ø4£©·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½ĪŖ_______________£»·“Ó¦¢ÜµÄ»Æѧ·½³ĢŹ½ĪŖ_________________”£
£Ø5£©EÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬·ūŗĻ”°¼ČÄÜ·¢ÉśŅų¾µ·“Ó¦ÓÖÄÜ·¢ÉśĖ®½ā·“Ó¦”±Ģõ¼žµÄEµÄĶ¬·ÖŅģ¹¹ĢåÓŠ_______ÖÖ£¬Š“³ö·ūŗĻÉĻŹöĢõ¼žĒŅŗĖ“Ź²ÕńĒāĘ×Ö»ÓŠ2×éĪüŹÕ·åµÄEµÄĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½£ŗ________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”潫51.2gCuĶźČ«ČÜÓŚŹŹĮæÅØĻõĖįÖŠ£¬ŹÕ¼Æµ½µŖµÄŃõ»ÆĪļ(ŗ¬NO”¢N2O4”¢NO2)µÄ»ģŗĻĪļ¹²0.8mol£¬ÕāŠ©ĘųĢåĒ”ŗĆÄܱ»500ml 2mol/LNaOHČÜŅŗĶźČ«ĪüŹÕ£¬Éś³Éŗ¬NaNO3ŗĶNaNO2µÄŃĪČÜŅŗ£¬ĘäÖŠNaNO2µÄĪļÖŹµÄĮæĪŖ( )
A.0.2molB.0.8molC.0.6molD.1.0mol
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com