
【题目】有下列各组微粒或物质: A、O2和O3
B、 ![]() 和
和 ![]()
C、CH3CH2CH2CH3和 ![]()
D、 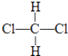 和
和 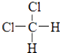
E、CH3CH2CH2CH3和 ![]()
(i)组两种微粒互为同位素;
(ii)组两种物质互为同素异形体;
(iii)组两种物质属于烃;
(iv)组两物质互为同分异构体;
(v)组两物质是同一物质.
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某学生甲设计了如下装置以验证亚硫酸与次氯酸的酸性强弱:H2SO3>HCl0。
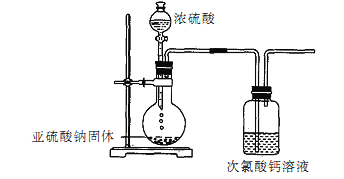
(1)甲得出结论的现象________________。
(2)学生乙对甲的实验结论提出了质疑,乙的理由是:____,随后对装置做了如下改进。

X、Y、Z是选用了下列部分试剂:饱和NaHC03溶液、品红溶液、NaOH溶液,乙得出结论的现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。请回答下列问题:
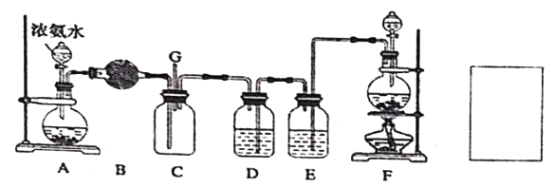
(1)装置F 为实验室制备氯气的装置,请写出实验室制备氯气的化学方程式________;
(2)装置A 中烧瓶内的固体可选用_____;装置B 中试剂可选用_____;
a.碱石灰 b.无水CuSO4 c.无水CaCl2 d.浓硫酸
(3)E 装置选用试剂的名称_____;
(4)装置C 内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
①请写出反应的化学方程式______________;
②并用单线桥表示电子转移的方向和数目。
③当有amol氯气参加反应时,转移的电子总数为b 个,则阿伏加德罗数常数表示为______________;(用含a、b 的代数式表示,结果注明单位)
(5)通入C 装置的两根导管左边较长、右边较短,目的是______________;从装置C 的G 处逸出的尾气中可能含有黄绿色的有毒气体,请在上图右边方框中画图,表示处理该气体的方法,并标出气流方向和所用试剂的名称。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图像中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量) ( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂有一个氯气钢瓶发生损坏,造成氯气泄漏。下列处理钢瓶的方法较合理的是
A.把钢瓶丢到深坑中,用石灰掩埋B.把钢瓶推到小河中
C.把钢瓶抬到下风口的地方并遗弃D.把钢瓶抬到上风口的地方并遗弃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2和SCl2均为重要的化工原料,都满足8电子稳定结构。
已知:①S2(1)+Cl2(g)![]() S2Cl2(g) △H1=xkJ/mol
S2Cl2(g) △H1=xkJ/mol
②S2Cl2(g)+Cl2(g)![]() 2SCl2(g) △H2=ykJ/mol
2SCl2(g) △H2=ykJ/mol
③相关化学键的键能如下表所示:
化学键 | S-S | S-Cl | Cl-Cl |
键能/kJ/mol | a | b | c |
下列说法错误的是
A. SCl2的结构式为C1-S-Cl B. S2Cl2的电子式为: ![]()
C. y=2b-a-c D. 在S2(1)+2Cl2(g)![]() 2SCl2(g)的反应中,△H=(x+y)kJ/mol
2SCl2(g)的反应中,△H=(x+y)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2L1mol·L-1的KCl溶液和0.5L1mol·L-1的FeCl3溶液中,Cl-的浓度之比是
A.1:3B.3:1C.1:1D.2:15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。

已知:①Fe3+ Cu2+ 开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为①
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com