
分析 (1)同质量的烃CxHy,$\frac{y}{x}$值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少;
(2)同状况、同体积、同物质的量的烃完全燃烧,耗氧量取决于x+$\frac{y}{4}$的相对大小;
(3)当温度大于100℃时,水为气态,当y=4时,燃烧前后体积不变.
解答 解:(1)同质量的烃CxHy,$\frac{y}{x}$值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少,则同质量的CH4、C2H4、C2H6三种有机物中CH4燃烧消耗氧气最多,C2H4生成的二氧化碳最多;
故答案为:CH4;C2H4.
(2)同状况、同体积、同物质的量的烃完全燃烧,耗氧量取决于x+$\frac{y}{4}$的相对大小;
CH4、C2H4、C2H6三种有机物中,x+$\frac{y}{4}$的值分别为2、3、3.5,故同物质的量的以上物质完全燃烧时耗O2的量最多的是C2H6,
故答案为:C2H6;
(3)当温度大于100℃时,水为气态,当y=4时,燃烧前后体积不变,故相同条件下测得反应前后气体体积没有发生变化的是CH4、C2H4,
故答案为:CH4、C2H4.
点评 本题考查烃燃烧烷烃,涉及耗氧量、生成二氧化碳与水的量、体积变化等,难度不大,注意根据燃烧通式进行理解,注意规律的掌握.


科目:高中化学 来源: 题型:选择题
| A. | 41 | B. | 72 | C. | 113 | D. | 185 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R为ⅡA族元素 | B. | R(OH)4是强碱 | ||
| C. | RCl2有还原性,容易被氧化 | D. | R2+的硝酸盐溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2Br和NaCN共热 | |
| B. | CH3CH2CH2CH2Br和NaOH的乙醇溶液共热 | |
| C. | CH3CH2CH2CH2Br和NaOH的水溶液共热 | |
| D. | CH3CH2CH2CH2Br(g)和Br2(g)光照 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
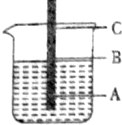 一根铁丝插入煮沸过的蒸馏水中,铁丝上有三点,问:
一根铁丝插入煮沸过的蒸馏水中,铁丝上有三点,问:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
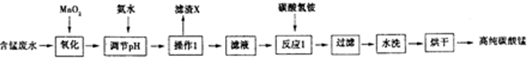
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe3+ | 1.5 | 3.1 |
| Fe2+ | 6.5 | 9.7 |
| Al3+ | 3.3 | 5.2 |
| Mn2+ | 7.8 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 总物质的量一定时,任意比混合,生成H2O的物质的量不同 | |
| B. | 总质量一定时,任意比混合,生成H2O的质量相同 | |
| C. | 总物质的量一定时,任意比混合,耗氧量相同 | |
| D. | 总质量一定时,任意比混合,耗氧量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| C. | 化合物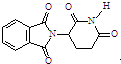 在酸性条件下水解,所得溶液加碱加热后有NH3生成 在酸性条件下水解,所得溶液加碱加热后有NH3生成 | |
| D. | 桶烯(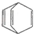 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com