
 +N2↑+3CO2↑
+N2↑+3CO2↑ +N2↑+3CO2↑,根据同周期从左到右非金属性逐渐增强,所以非金属性由强到弱的顺序依次为:O、N、C;
+N2↑+3CO2↑,根据同周期从左到右非金属性逐渐增强,所以非金属性由强到弱的顺序依次为:O、N、C; ,
, ;
;

科目:高中化学 来源: 题型:
| A、冰融化成水放出热量 |
| B、化学键断裂过程一定放出能量 |
| C、生成物的总能量一定低于反应物的总能量 |
| D、化学键的断裂和形成是化学反应中能量变化的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
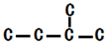 ,此烷烃的一溴代物有
,此烷烃的一溴代物有查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
| CH4 | CO
|
C2O
|
|||||||||
NH
|
N2H
|
NO
|
N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
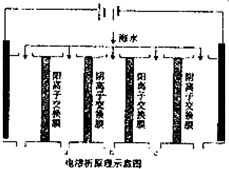 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水的处理主要包括水的净化、污水处理、硬水软化和海水的淡化等.
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水的处理主要包括水的净化、污水处理、硬水软化和海水的淡化等. ,请写出ABS的结构简式
,请写出ABS的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
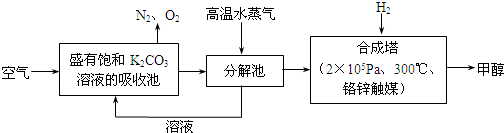
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com