
【题目】高铁酸钠(Na2FeO4)是一种新型绿色水处理剂。 工业上可用电解浓NaOH溶液制备Na2FeO4,其工作原理如图所示,两端隔室中离子不能进入中间隔室。下列说法错误的是

A. 阳极电极反应式:Fe-6e- +8OH-=FeO42- +4H2O
B. 甲溶液可循环利用
C. 离子交换膜a是阴离子交换膜
D. 当电路中通过2mol电子的电量时,会有1molH2生成
【答案】C
【解析】分析:根据工业上电解浓NaOH溶液制备Na2FeO4,故铁做阳极,铁放电生成FeO42-,铜棒做阴极,水电离出的氢离子放电生成氢气和氢氧根,导致阴极室溶液产生大量OH-,则吸引中间隔室中的Na+移向阴极室,故所得溶液甲为浓的NaOH溶液。中间隔室中的NaOH溶液浓度降低。
详解:A. 阳极发生氧化反应,电极反应式:Fe-6e- +8OH-=FeO42- +4H2O,故A正确;B.阴极发生还原反应,水电离出的氢离子放电生成氢气和氢氧根,甲溶液为浓的氢氧化钠溶液,可循环利用,故B正确;C. 电解池中阳离子向阴极移动,通过离子交换膜a的是Na+,故为阳离子交换膜,故C错误;D. 阴极发生还原反应,水电离出的氢离子放电生成氢气和氢氧根,电极反应式为2H2O+2e- = H2↑+ 2OH―,当电路中通过2mol电子的电量时,会有1molH2生成,故D正确;故选C。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中的位置如下图所示,则下列说法中错误的是
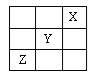
A. X元素的最外层电子数为2
B. Y的气态氢化物的化学式为HY
C. Z的最高价氧化物的化学式为ZO2
D. X、Y、Z的单质中X单质最稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应2KI+O3+H2O ==2KOH+I2+O2,下列说法正确的是
A.当有2 molKI被氧化时,2 mol氧原子被还原
B.O2是还原产物
C.若消耗2.24 L O3,则转移0.2 mol电子
D.氧化剂与还原产物的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种离子的还原能力强弱顺序为I->Fe2+>Br-,现有200 mL混合溶液中含FeI2、FeBr2各0.10 mol,向其中逐滴滴入氯水(假定Cl2分子只与溶质离子反应,不考虑其他反应)
(1)若氯水中有0.15 mol Cl2被还原,则所得溶液中含有的阴离子主要是________,剩余Fe2+的物质的量为________。
(2)若原溶液中Br-有一半被氧化,共消耗Cl2的物质的量为________,若最终所得溶液为400 mL,其中主要阳离子及其物质的量浓度为________。
(3)通过对上述反应的分析,试判断Cl2,I2,Fe3+,Br2四种氧化剂的氧化能力由强到弱的顺序是_________________________________________________。
(4)上述反应若原溶液中溶质离子全部被氧化后,再滴入足量氯水,则I2全部被Cl2氧化成HIO3(强酸)。试写出此反应的离子方程式:_________________;上述所有反应共消耗Cl2________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2,为了检验产物中的H2和CO(设气体均被充分吸收),设计如下实验装置。下列有关说法错误的是
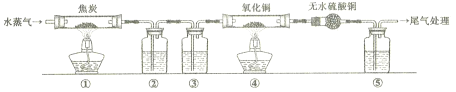
A. 为了实验安全,应先点燃①处酒精灯,后点燃④处酒精灯
B. ②、③、⑤中依次盛装氢氧化钠溶液、浓硫酸和澄清石灰水
C. ④中黑色固体变红色,即可证明产物中一定含有H2和CO中的一种或两种
D. 若用碱石灰替换无水硫酸铜,也可以达到检验H2和CO目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示不同化学元素所组成的化合物,以下说法不正确的是

A. 若图中①为某种多聚体的单体,则①最可能是氨基酸
B. 若②存在于皮下和内脏器官周围等部位,则②是脂肪
C. ③一定是核酸或是组成核酸的单体核苷酸
D. 若④是参与构成植物细胞壁的一种多糖,则④最可能是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧产生的SO2、CO、NO2等造成了严重的大气污染问题。
(1) CaO能起到固硫、降低SO2排放量的作用。
已知:①SO2(g)+ CaO(s)=CaSO3(s) △H=-402 kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H=-234 kJ·mol-1
③CaCO3(s)=CO2(g) +CaO(s) △H = +178 kJ·mol-1
则反应2SO2(g)+O2(g)+2CaO(s)= 2CaSO4(s) △H =________ kJ·mol-1
向燃煤中加入CaCO3也可起到固硫作用,若固定2molSO2相应量的煤在相同条件下,燃烧时向环境释放出的热量会减少______ kJ。
(2)利用CO和H2在催化剂作用下合成甲醇,是减少污染的一种新举措,反应原理为CO(g)+2H2(g) ![]() CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
CH3OH(g)△H,在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图甲。
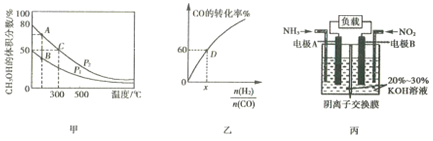
①上述合成甲醇的反应是______(填“吸热”或“放热”)反应,判断的理由是_____。
②图甲中A、B、C三点中反应速率最大的是______(填写“A”、“ B” 或“ C”)。
③在300℃时,向C点平衡体系中再充入0.25molCO,0.5molH2和0.25molCH3OH,该平衡______(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
的变化关系如图乙所示,测得D点氢气的转化率为40%,则x=______。
(4)利用原电池原理可将NO2和NH3转化为无污染物质,其装置原理图如图丙所示,则负极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为![]() 。下列比较中正确的是( )
。下列比较中正确的是( )
A. 原子半径:a>c>d>b B. 电负性a>b>d>c
C. 原子序数:d>a>c>b D. 最高价含氧酸的酸性c>d>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有NaBr、NaI的溶液中通入过量的Cl2 , 然后将溶液蒸干,并灼烧固体,最后得到的物质是( )
A.NaCl
B.NaCl和NaBr
C.NaCl和NaI
D.NaCl和I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com