
| A. | 它是一种白色粉末,溶解度小于Na2CO3 | |
| B. | 加热至200℃左右,可完全分解,利用这种性质,可由NaHCO3制取纯碱 | |
| C. | 与Na2CO3相同质量时,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳 | |
| D. | 它是一种碳酸盐 |
分析 A、相同条件下,碳酸氢钠的溶解度小;
B、碳酸氢钠不稳定;
C、碳酸氢钠中含碳高于碳酸钠;
D、碳酸钠是碳酸盐,而碳酸氢钠是碳酸氢盐.
解答 解:A、Na2CO3和NaHCO3在相同条件下,碳酸氢钠的溶解度小,则在水中的溶解度为:Na2CO3>NaHCO3,故A正确;
B、碳酸氢钠不稳定,碳酸氢钠也可以加热分解生成碳酸钠,故B正确;
C、碳酸氢钠中含碳高于碳酸钠,所以相同质量的NaHCO3与Na2CO3,分别跟足量盐酸反应后,则NaHCO3可得到较多的二氧化碳,故C正确;
D、碳酸钠是碳酸盐,而碳酸氢钠是碳酸氢盐,碳酸氢钠是酸式盐,故D错误;
故选D.
点评 本题考查了碳酸钠、碳酸氢钠的性质,注重了基础知识考查,本题难度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 大力提倡开发化石燃料作为能源 | |
| B. | 研发新型催化剂,提高石油和煤中各组分的燃烧热 | |
| C. | 化石燃料属于可再生能源,不影响可持续发展 | |
| D. | 人类应尽可能开发新能源,取代化石能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
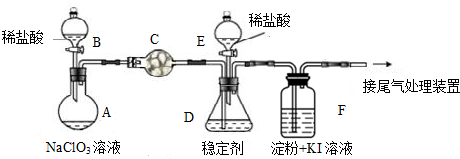
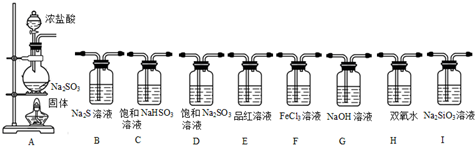
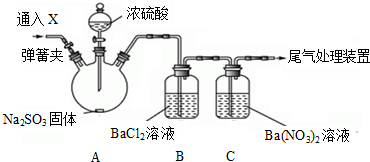

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸盛放在玻璃试剂瓶中 | |
| B. | 浓硝酸盛在棕色试剂瓶中 | |
| C. | 氢氧化钠溶液盛在带橡皮塞的玻璃瓶中 | |
| D. | 氯水盛在棕色试剂瓶中,并放置在冷暗处 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,14 g乙烯中含碳原子数为NA | |
| B. | 1 mol NH4+与1 mol OH-所含的电子数均为10NA | |
| C. | 常温常压下,22.4L CH4中含C-H键数目为4NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有0.1 mol•L-1 Fe3+的溶液中:H+、Fe2+、Na+、I- | |
| B. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| C. | 在pH=1的溶液中:Mg2+、Na+、ClO-、NO3- | |
| D. | 加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图试管中盛有酸雨浸泡过的铁钉,U形管中盛有一段红墨水.开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )
如图试管中盛有酸雨浸泡过的铁钉,U形管中盛有一段红墨水.开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升.下列说法不正确的是( )| A. | 开始时发生的是析氢腐蚀 | B. | -段时间后发生的是吸氧腐蚀 | ||
| C. | 两段时间内负极的电极反应相同 | D. | 两段时间内正极的电极反应相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
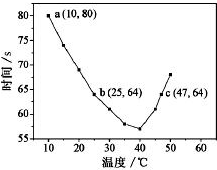 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 当NaHSO3完全消耗时的离子方程式为:6HSO3-+2IO3-=6SO42-+2I-+6H+ | |
| C. | 图中a点对应的NaHSO3反应速率为5.5×10-5mol•L-1•s-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该实验的指示剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com