
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 的分子式均为C8H8,下列说法正确的是( )
(z) 的分子式均为C8H8,下列说法正确的是( )
A. x完全氢化后的产物为q,q的一氯代物有六种同分异构体
B. x、y、z中的所有原子不可能都处于同一平面上
C. 可以用y萃取溴水中的溴
D. x的同分异构体只有y和z两种
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】某酸溶液的pH=1,此酸溶液的物质的量浓度( )
A. 为0.1 mol/L
B. 一定大于0.1 mol/L
C. 若为强酸一定等于0.1 mol/L,若为弱酸一定大于0.1 mol/L
D. 若为强酸一定小于或等于0.1 mol/L,若为弱酸一定大于0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在试管a中先加入3mL95%的乙醇,边摇动边缓缓加入2mL浓H2S04并充分摇匀,冷却后再加入2mL冰醋酸,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入 7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。
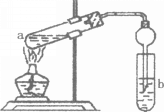
①加入浓H2S04的作用是_________________________;
②试管b中观察到的主要现象是_________________________________;
③在实验中球形干燥管除起冷凝作用外,另一个重要作用是______________;
④饱和Na2C03溶液的作用是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中进行的反应N2+O2![]() 2NO,下列条件能加快其反应速率的是( )
2NO,下列条件能加快其反应速率的是( )
A. 增大体积使压强减小 B. 压强不变,充入气体Ne
C. 体积不变,充入N2使压强增大 D. 体积不变,充入He使压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯加水,则灯泡会亮起来:
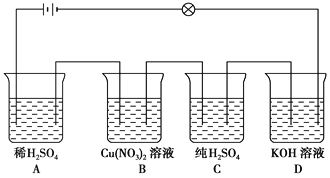
则:
(1)加水的烧杯为________。
(2)写出B、D烧杯中电解质的电离方程式:
B.___________________________________________________________________;
D.__________________________________________________________________。
(3)若在A烧杯中加入少量Ba(OH)2溶液后,溶液的导电性________,继续滴加Ba(OH)2溶液,可观察到灯泡的亮度________至________后又逐渐________。写出发生反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸米多君是临床常用的升压药,其一种合成路线如下:
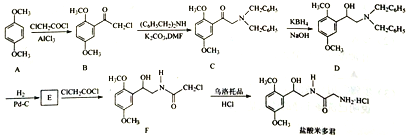
(1)盐酸米多君中含氧官能团名称为_____________(只写两种)。
(2)B→C的反应类型为___________。
(3)写出满足下列条件的B的一种同分异构体的结构简式:_______。
①含有苯环,分子中有一个手性碳原子,能发生银镜反应,与FeCl3溶液发生显色反应,在酸性条件下水解可生成两种有机物。
②分子中只有5种不同化学环境的氢。
(4)E的分子式为C10H15O3N,经取代得到F。写出E的结构简式:_______。
(5)已知:![]() ,请写出以
,请写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图______(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图______(无机试剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )
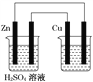
A. 铜在原电池中作负极,在电镀池中作阳极
B. 原电池溶液增加的质量比电镀池阴极增加的质量大
C. 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol
D. 电镀池中的电解质溶液可用ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红。填空完成问题:
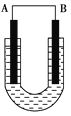
①A是原电池的_______极,代表金属____(填“铜”或“铁”);
②电极方程式分别为正极:______________________,原电池反应为_____________________________________。
(2)请从图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25 mL),并检验氯气的氧化性。
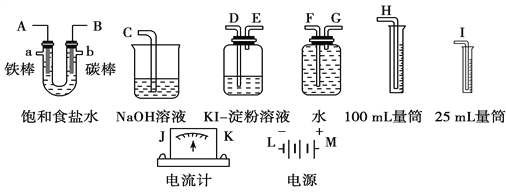
①A极发生的电极反应式是________________,B极发生的电极反应式是_______________。
②设计上述气体实验装置时,各接口的正确连接顺序为_________________________________________________________。
③实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2具有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能发生反应。为了验证此推测结果,该同学设计并进行如图所示实验。
Ⅰ.实验探究
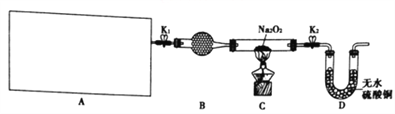
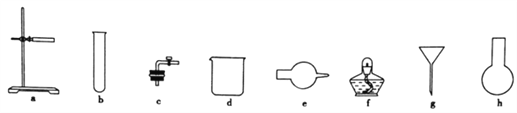
(1)图中A是制取氢气的装置,从图所示的仪器中选择一部分组装成一套能随开随停的装置,选择的仪器编号是_________。
(2)装置A中用粗锌和稀盐酸制取氢气,B装置中所盛放的试剂是_________,其作用是________。
(3)下面是实验过程中的重要操作,正确的顺序是_________(填入下列步骤的字母)。
A.加热至Na2O2逐渐熔化,反应一段时间 B.用小试管收集气体并检验其纯度
C.打开K1、K2 通入氢气 D.停止加热,充分冷却,关闭K1、K2
(4)实验过程中观察到淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。由此可推出Na2O2与H2反应的化学方程式为___________________________________________________。
Ⅱ.数据处理
(5)实验结束后,该同学欲测定C 装置硬质玻璃管内白色固体中未反应完的Na2O2含量。其操作流程如下:![]()
①测定过程中需要的仪器除固定、夹持仪器外,还有电子天平、烧杯、酒精灯、蒸发皿和_________,操作2的名称是_________。
②在转移溶液时,若溶液转移不完全,则测得的Na2O2质量分数_________(填“偏 大” “偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com