
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体。Fe(OH)3有吸附性,可吸附污物使之沉积下来,具有净化水的作用。模拟处理装置如图所示,下列说法错误的是( )
A.X电极是负极,电极反应式为CH4-8e-+4CO32-=5CO2+2H2O

B.铁作阳极,失去电子生成Fe2+
C.工作时熔融盐中的碳酸根移向Y电极
D.污水中存在反应4Fe2++10H2O+O2=4Fe(OH)3↓+8H+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学名师知识点精编 专题14无机非金属材料-碳和硅练习卷(解析版) 题型:选择题
下列关于物质的性质与用途的说法中不正确的是( )
A.氧化铝的熔点很高,因此可用作耐火材料
B.某些金属氧化物灼烧时有特殊的颜色,因此可用于制造烟花
C.氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃
D.氯气具有强氧化性,因此可用于漂白有色布料
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:填空题
如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
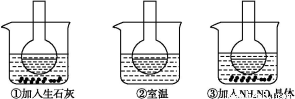
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是 。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为 、 、 、 (填“左”、“右”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷B(解析版) 题型:选择题
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ Fe2++Cr3+。下列说法一定正确的是( )
Fe2++Cr3+。下列说法一定正确的是( )
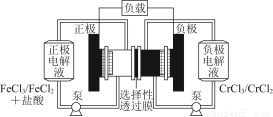
A.充电时,阴极的电极反应式为Cr3++e-=Cr2+
B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+
C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室
D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷A(解析版) 题型:选择题
如图所示,通电一段时间后,Cu电极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为100 mL,则通电前A池中原混合溶液Cu2+的浓度为( )
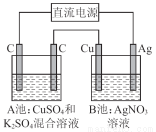
A.0.05 mol/L B.0.035 mol/L
C.0.025 mol/L D.0.020 mol/L
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:实验题
人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。
试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与KMnO4反应的离子方程式为______________________________________
(3)滴定时,根据现象___________________________________
即可确定反应达到终点。
(4)滴定的实验数据如下所示:
实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
1 | 20.00 | 11.95 |
2 | 20.00 | 13.00 |
3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。以AgNO3标准溶液测定Cl-为例:
终点前:Ag++Cl-=AgCl (白色)
终点时:2Ag++CrO42—=Ag2CrO4(砖红色)
这是因为AgCl溶解度比Ag2CrO4更________的缘故。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷B(解析版) 题型:选择题
常温时,下列叙述正确的是( )
A.稀释pH=10的氨水,溶液中所有离子的浓度均降低
B.pH均为5的HCl和NH4Cl溶液中,水的电离程度相同
C.NaOH和CH3COONa的混合溶液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
下列有关说法正确的是( )
A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7
B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
C.pH=6的纯水中,c(OH-)=10-8 mol·L-1
D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题5化学反应中的能量变化练习卷(解析版) 题型:选择题
已知:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol;②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com