
分析 Ⅰ.(1)基态N原子中电子在2p轨道上的排布遵循的原则是洪特规则,N2F2分子中N原子之间形成N=N双键,N原子与F原子之间形成N-F键,N原子含有1对孤对电子;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大;
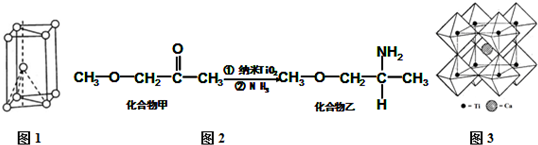
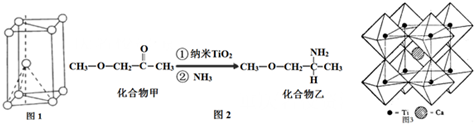
II.(3)核外电子没有运动状态相同的电子;由金属钛晶胞结构可知,属于六方最密堆积;
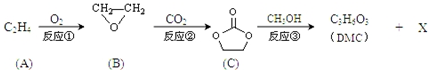
(4)化合物甲与化合物乙均为分子晶体,但化合物乙分子间可形成氢键;化合物乙中C、N、O三种原子的杂化轨道形成均为sp3,同周期自左而右电负性增大;
(5)钛晶矿晶胞中钛离子与周围六个氧原子包围形成八面体,立方体晶胞共有12个边长,每条边长的中点是一个氧原子,共12个氧原子包围着中心的钙离子.
解答 解:Ⅰ.(1)基态N原子中电子在2p轨道上的排布遵循的原则是洪特规则,N2F2分子结构式为F-N=N-F,分子中N原子含有1对孤对电子,N原子的杂化方式是sp2杂化,l mol N2F2含有3molσ键,即1.806×1024个σ键,
故答案为:洪特规则;sp2杂化;1.806×1024;
(2)Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′,
故答案为:>;Si3N4晶体中Si原子周围有4个N原子,Si原子为sp3杂化,N-Si-N键角为109°28′,N原子周围连接3个Si原子,含有1对孤对电子,N原子为sp3杂化,但孤对电子对成键电子对的排斥作用更大,使得Si-N-Si键角小于109°28′.
II.(3)Ti原子核外电子数为22,核外共有22种运动状态不相同的电子;由金属钛晶胞结构可知,属于六方最密堆积;
故答案为:22;六方最密;
(4)化合物乙因分子间存在氢键,则化合物乙的沸点比化合物甲高,化合物乙中C、N、O三种原子的杂化轨道形成均为sp3,同周期自左而右电负性增大,故电负性:O>N>C,
故答案为:化合物乙分子间形成氢键;O>N>C;
(5)钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围,
故答案为:12.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道与空间构型、化学键、氢键、电负性、晶胞结构与计算等,Ⅱ(5)中晶胞结构与计算为易错点,需要显示具备一定的空间想象与数学计算能力,题目难度中等.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:推断题
 ;
; )在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n
)在一定条件下可发生类似反应①的反应,生成芳香族聚碳酸酯,写出反应的化学方程式:2n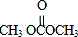 +n
+n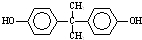 →
→ +4nCH3OH.
+4nCH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在分子组成上相差一个或若干个CH2原子团的物质一定互称为同系物 | |
| B. | 具有同分异构现象的有机化合物互称为同分异构体 | |
| C. | 同素异形体是指同种元素形成不同的单质 | |
| D. | 含有相同的质子数而不同的中子数的同一类元素的原子互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L 甲醇完全燃烧后生成的 CO2 分子个数约为$\frac{1}{2.42}$N A | |
| B. | N A个H2分子的质量约为2g,它所占的体积约为 22.4L | |
| C. | 标准状况下,22.4L CO2与CO的混合气体中含有的碳原子数为N A | |
| D. | 500mL 0.5mol/L 的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷、水泥、石英玻璃、光导纤维均属于硅酸盐产品 | |
| B. | 煤干馏得到的煤焦油,其主要用途是经蒸馏得到燃油,这一应用可体现“低碳生活”的理念 | |
| C. | 埃博拉病毒对化学药品敏感,乙醇、酚类、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 扫描隧道显微技术、超分辨荧光显微技术等科技手段的发展,促进了人类对微观结构的探索,可实现对原子或分子的操控,使科学研究迈入更高水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
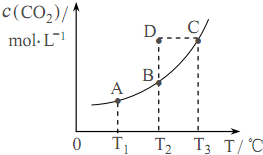 在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )
在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| B. | 在T2时,若反应处于状态D,则一定有V正<V逆 | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H<0 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
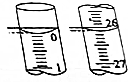 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:实验题
用碳酸钠晶体(Na2CO3•10H2O),配制0.2mol/L的Na2CO3溶液480mL。
(1)所需主要仪器为:药匙、托盘天平、烧杯、玻璃棒、_________和胶头滴管。
(2)本实验所需称量碳酸钠晶体(Na2CO3•10H2O)_________g;
(3)根据下列操作对所配溶液的浓度产生的影响,完成下列要求。
①Na2CO3•10H2O晶体失去了部分结晶水
②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠
④称量碳酸钠晶体时所用砝码生锈
⑤容量瓶未经干燥就使用
其中引起所配溶液浓度偏高的有_________,偏低的有__________,无影响的有_________。(填序号)
(4)某同学改用固体Na2CO3配制上述Na2CO3溶液的过程如图所示:

你认为该同学的操作步骤中错误(包含遗漏)之处有___________。
A.1处 | B.2处 | C.3处 | D.4处 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com