
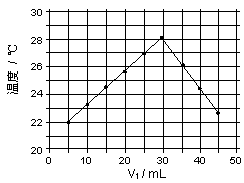
将V1mL1.0mol/LNaOH溶液和V2mL未知浓度的HCl溶液混合均匀后测量并记录溶液温度,实验结果如右图所示(实验中始终保持V1+V2=50mL)。下列叙述不正确的是
A 做该实验时环境温度低于22℃
B 该实验表明化学能和热能可以相互转化
C HCl溶液的浓度大于1.0mol/L
D 该实验表明当V1=30mL恰好中和
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
将SO2气体分别通入下列四种溶液中,有关现象及结论的说法正确的是( )
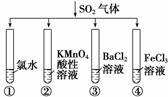
A.试管①中有淡黄色沉淀生成,说明SO2有氧化性
B.试管②中溶液褪色,说明SO2有漂白性
C.试管③中无明显现象
D.试管④中溶液颜色变浅,说明SO2有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示的是N2 + 3H22NH3 △H<0达到平衡后,改变条件建立的新平衡(图中横坐标表示反应时间, 纵坐标表示反应速率)
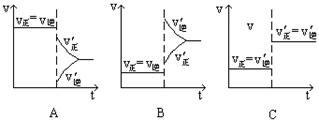
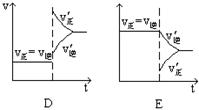
(1)表示减少H2的量而建立新平衡的是 。
(2)表示压缩气体, 体积减小而建立新平衡的是 。
(3)表示降低温度而建立新平衡的是 。
(4)表示升高温度而建立新平衡的是 。
(5)表示加入催化剂后而建立新平衡的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,在常况下容器 A 中盛有 500mL 蒸馏水,在容器 B 中盛有 500ml 1mol/L的盐酸,在烧瓶 C 和 D 中充满二氧化氮气体,并用导管将它们连通。向 A 容器中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入 10g 苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶 C 和 D 中气体的颜色变化是
A. 不变 B. 烧瓶 C 中颜色变深,D 中变浅
C. 烧瓶 D 中变深, C 中变浅 D. 两个烧瓶中的颜色都变深
查看答案和解析>>
科目:高中化学 来源: 题型:
现有可逆反应m A(g)+ n B(g)  x C(g);ΔH = a kJ/mol。该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示。下列判断正确的是
x C(g);ΔH = a kJ/mol。该反应在不同温度和压强条件下,反应物A的转化率的变化情况如图所示。下列判断正确的是
 A.a < 0,m+n < x
A.a < 0,m+n < x
B.a < 0,m+n > x
C.a > 0,m+n < x
D.a > 0,m+n > x
查看答案和解析>>
科目:高中化学 来源: 题型:
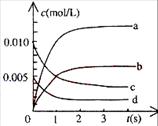
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)
在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
(1)写出该反应的平衡常数表达式:K=___________________。
已知:K(300℃)>K(350℃),该反应的正向是________热反应。
(2)右图中表示NO2的变化的曲线是____________。
(3)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
将4 molA气体和2molB气体在2L的容器中混合,一定条件下发生如下反应:2A(g)+B(g)=2C(g)若经2s(秒)后测得C的浓度为0.6mol·L-1 ,下列说法正确的是
A.2 s 时物质 A 的转化率为70%
B.用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1
C.用物质 A 表示的反应的平均速率为 0.3 mol·L-1·s-1
D.2 s 时物质 B 的浓度为 0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应mA(固)+nB(气) e C(气)+f D(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是
e C(气)+f D(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是
A.达平衡后,加入催化剂则C%增大
B.达平衡后,增加A的量有利于平衡向右移动
C.化学方程式中n>e+f
D.达平衡后,若升温,平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
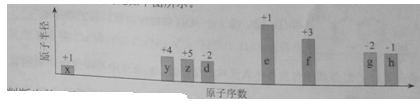
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
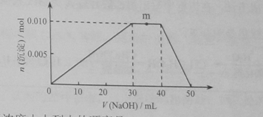
①R离子浓度由大到小的顺序是:__________。
②写出m点反应的而梨子方程式_________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com