
【题目】汽车尾气净化中的一个反应如下:
NO(g)+CO(g)![]()
![]() N2(g)+CO2 (g) ΔH=-373.4 kJ·mol-1
N2(g)+CO2 (g) ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
A.  B.
B. 
C.  D.
D. 
科目:高中化学 来源: 题型:
【题目】全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是
A. 太阳能、地热能、生物质能和核聚变能均属于“新能源”
B. “低碳”是指采用含碳量低的烃类作为燃料
C. 如图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想
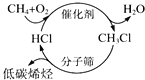
D. 让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物的知识贯穿整个高中学习,通过《化学反应原理》这本书的学习更是加深了对它们的认识。
(1)亚磷酸是二元弱酸。已知:
![]()
![]()
![]()
求![]()
![]()
![]() ______________
______________
(2)亚磷酸溶液与硝酸银溶液混合生成单质银和NO,写出该反应的离子方程式_________
(3)关于![]() 溶液,下列表达正确的是_____
溶液,下列表达正确的是_____
A.![]()
B.![]()
C.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开(或生成)1 mol 某化学键所吸收(或放出)的能量看成该化学键的键能。化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | A—A | B—B | A—B |
生成1mol化学键时放出的能量 | 436kJ/mol | 243kJ/mol | 431kJ/mol |
则下列热化学方程式不正确的是
A.![]() A2(g)+
A2(g)+![]() B2(g)=AB(g) ΔH=-91.5kJ/mol
B2(g)=AB(g) ΔH=-91.5kJ/mol
B.A2(g)+B2(g)=2AB(g) ΔH=-183kJ/mol
C.![]() A2(g)+
A2(g)+![]() B2(g)=AB(g) ΔH=+91.5kJ/mol
B2(g)=AB(g) ΔH=+91.5kJ/mol
D.2AB(g)=A2(g)+B2(g) ΔH=+183kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
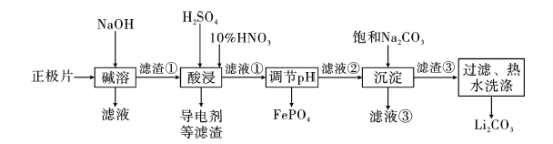
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
已知:KSP ( Li2CO3)=2.0×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1) 流程中用“热水洗涤”的原因是____________。
(2)写出碱溶时Al箔溶解的化学方程式 ___________。
(3)酸浸时,用H2O2代替HNO3更好,其优点是________。
(4)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为____。
(5)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3溶液后,Li+的沉降率达到90%,计算滤液③中c(CO32-)=____mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列不能用勒夏特列原理解释的是( )
A.H2、I2、HI混合气体加压后颜色变深
B.合成氨时将氨液化分离,可提高原料的利用率
C.向氯水中缓慢加入硝酸银固体,氯水颜色变浅
D.使用MnO2作催化剂能加速H2O2的分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的密闭容器中存在化学平衡:2NO2(g)![]() N2O4(g),ΔH<0。保持温度不变,将容器体积增大至2V后,下列说法不正确的是( )
N2O4(g),ΔH<0。保持温度不变,将容器体积增大至2V后,下列说法不正确的是( )
A.容器内气体颜色变深B.容器内N2O4分子数减小
C.混合气体的平均相对分子质量增大D.NO2的物质的量分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论不正确的是
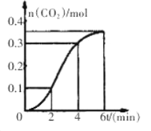
A.反应开始2分钟内平均反应速率最大
B.反应4分钟后平均反应速率最小
C.反应开始4分钟内温度对反应速率的影响比浓度大
D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示:

(1)A中制取Cl2的反应的化学方程式是_________________________。
(2)B装置的作用:①______;②______;③______。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是________________。
(4)E装置的作用是_____(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(6)将1 mol CH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com