
将N2和 H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:
(1)反应前混合气体中N2和 H2的体积比;
(2)达到平衡时混合气体中的氨的体积分数;
(3)平衡时N2的转化率。
(1)1:4(2分)(2)31.6%(3分)(3)60%(3分)
解析试题分析:(1)N2和H2按一定比例混合,在相同状况下其密度是H2的3.6倍,则混合气体的平均相对分子质量=3.6×2=7.2,令0.5mol混合气体中N2和H2的物质的量分别为xmol、ymol,则:
x+y=0.5
28x+2y=7.2(x+y)
解得x=0.1,y=0.4,体积之比等于物质的量之比,故反应前混合气体中N2和H2的体积比=0.1:0.4=1:4;
(2)根据压强之比等于物质的量之比,故反应后容器内混合气体总的物质的量=0.5mol×0.76=0.38mol,则:
N2 + 3H2 = 2NH3
平衡时(mol) 0.1-a 0.4-3a 2a
则0.1-a + 0.4-3a + 2a ="0.38" ,解得a=0.06mol,n(NH3)=2a=0.12mol
故NH3 的体积分数=n(NH3)/n总×100%=0.12mol/0.38mol×100%=31.6%;
(3)氮气的转化率="a/" n(起始N2)×100%=0.06mol/0.1mol×100%=60%
考点:本题考查的是化学平衡的计算。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:问答题
(18分)碱金属元素的单质及其化合物被广泛应用于生产、生活中。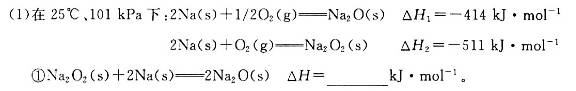
②一定量的Na在足量O2中充分燃烧,参加反应的O2体积为5.6 L(标准状况),则该反应过程中转移电子的数目为_________。
(2)金属锂广泛应用于化学电源制造,锂水电池就是其中的一种产品。该电池以金属锂和 钢板为电极材料,以LiOH为电解质,加入水即可放电。
总反应为:2Li+2H2O=2LiOH+H2↑
①锂水电池放电时,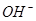 向_________极移动。
向_________极移动。
②写出该电池放电时正极的电极反应式:_________________。
③电解熔融LiCl可以制备金属Li。但LiC1熔点在873 K以上,高温下电解,金属Li产量极低。经过科学家不断研究,发现电解LiCl—KCl的熔盐混合物可以在较低温度下生成金属Li。
你认为,熔盐混合物中KCl的作用是_________________________________________。
写出电解该熔盐混合物过程中阳极的电极反应式:______________________________。
(3)最新研究表明,金属钾可作工业上天然气高温重整的催化剂,有关反应为: 。一定温度下,向2 L容积不变的密闭容器中充入4 mol
。一定温度下,向2 L容积不变的密闭容器中充入4 mol 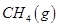 和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
和6 mo1 H2O(g)发生反应,10 min时,反应达到平衡状态,测得CH4(g)和H2(g)的物质的量随时间变化的曲线如图所示。
①0~10 min内用 (CO)表示的化学反应速率为_________。
(CO)表示的化学反应速率为_________。
②下列叙述中,能够证明该反应已达到平衡状态的是_________(填序号)。
a.生成3 molH-H键的同时有4 molC-H键断裂
b.其他条件不变时,反应体系的压强保持不变
c.反应混合气体的质量保持不变
d.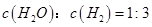
③此温度下,该反应的化学平衡常数K=_________mo12·L-2。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
加热时,N2O5可按下列分解:N2O5 N2O3 + O2,N2O3又可按下列分解: N2O3
N2O3 + O2,N2O3又可按下列分解: N2O3 N2O + O2。今将 4 molN2O5充入一升密闭容器中,加热至 t℃时反应达到了平衡状态。平衡时,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L,c(N2O)= mol/L,此时N2O5的分解率为 。
N2O + O2。今将 4 molN2O5充入一升密闭容器中,加热至 t℃时反应达到了平衡状态。平衡时,c(O2)=" 4.5" mol/L, c(N2O3)=" 1.62" mol/L,c(N2O)= mol/L,此时N2O5的分解率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t时到达平衡,依图所示:
①该反应的化学方程式是 。
②反应起始至t,Y的平均反应速率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在密闭容器中,将1.0molCO与1.0molH2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g) CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol。求:
(1)达到平衡时CO2的物质的量分数和该反应的化学平衡常数;
(2)达到平衡后向该平衡体系中通入1.0mol水蒸气,达到新的平衡状态时,求水蒸气的物质的量和CO2的物质的量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(1)将不同量的CO(g)和H2O(g)分别通入体积2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。若再加入双氧水,将发生反应:H2O2+2H++2I—→2H2O+I2,且生成的I2立即与试剂X反应而被消耗。一段时间后,试剂X将被反应生成的I2完全消耗。由于溶液中的I—继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝。因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I—→2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol·Lˉ1 KI溶液 | H2O | 0.01 mol·Lˉ1 X溶液 | 0.1 mol·Lˉ1 双氧水 | 1 mol·Lˉ1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
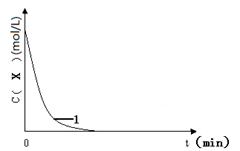
 2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。
2AlI3(s)。含I—传导有机晶体合成物作为电解质,该电池负极的电极反应为:______________________________,充电时Al连接电源的___________极。查看答案和解析>>
科目:高中化学 来源: 题型:实验题
控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50ml稀盐酸和1g碳酸钙反应的实验数据:
| 实验 序号 | 碳酸钙状态 | c(HCl)/mol·L-1 | 溶液温度/oC | 碳酸钙消失时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
甲、乙两个实验小组分别利用KMnO4酸性溶液与H2C2O4溶液反应进行研究外界因素对反应速率的影响。设计实验方案如下:
甲组:通过测定生成CO2气体体积的方法来比较化学反应速率的大小。
实验装置如图,实验时分液漏斗中A溶液一次性放入B溶液中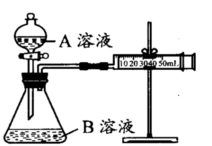
(注:实验中所用KMnO4溶液均已加人相同量H2SO4):
| 序号 | A溶液 | B溶液 |
| ① | 2 mL 0.1mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
| ② | 2 mL 0.2mol/LH2C2O4溶液 | 4 mL0.01mol/LKMnO4溶液 |
| 时间(min) | 4 | 8 | 12 | 16 | 21 | 22 | 23 | 24 | 25 |
| c(KMnO4)(10-4mol/L) | 4.58 | 4.02 | 3.36 | 2.25 | 0.72 | 0.43 | 0.23 | 0.16 | 0.13 |
| υ(KMnO4) (10-4mol/(L·min) | υ | 0.14 | 0.17 | 0.28 | 0.32 | 0.29 | 0.20 | 0.07 | 0.03 |
| 实验步骤及结论: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com