
(11分)已知N2O4 (g)  2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,
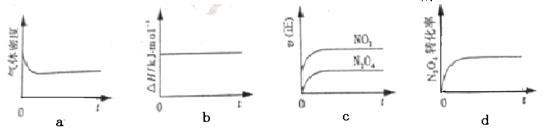
(1)现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”、“不变”或“减小” )。反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·S-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填”正向”“不”或“逆向”)移动。
(2分)(1)a、d
(4分)(2)不变 0.1mol·L-1·s-1
(5分)(3)NH4++H2O NH3·H2O+H+ 逆向
NH3·H2O+H+ 逆向
【解析】
试题分析:(1)化学反应平衡的判断可从以下几方面考虑:体系中所有反应物和生成物的质量(或浓度)保持不变,正反应速率等于逆反应速率。对于N2O4 (g)  2NO2 (g),反应后体积变大,a密度不变,说明体积不变,故平衡;bΔH=E生-E反,ΔH不随时间的变化,但会随着化学计量数的变化而变化;c化学平衡应该是正逆反应速率相等,而图中表示的都是正反应速率;dN2O4的转化率不变,也说明了化学反应达到平衡。
2NO2 (g),反应后体积变大,a密度不变,说明体积不变,故平衡;bΔH=E生-E反,ΔH不随时间的变化,但会随着化学计量数的变化而变化;c化学平衡应该是正逆反应速率相等,而图中表示的都是正反应速率;dN2O4的转化率不变,也说明了化学反应达到平衡。
(2)化学平衡常数只是温度的函数,故温度不变,平衡常数就不变。
N2O4 (g)  2NO2 (g)
2NO2 (g)
n前 1 0
n反 0.3 0.6
n后 0.7 0.6
V(N2O4)=0.3molL_1/3s=0.1molL_1/s
(3)NH4NO3是强酸弱碱盐,故水溶液铵根会水解,使溶液显酸性,方程式为NH4++H2O NH3·H2O+H+,氨水是弱碱,弱碱是抑制水的电离,故水的电离平衡将逆向进行。
NH3·H2O+H+,氨水是弱碱,弱碱是抑制水的电离,故水的电离平衡将逆向进行。
考点:反应平衡移动和电离水解
点评:此题考核了化学反应平衡的判断,也考核了化学平衡常数的知识和电离水解知识,要牢记盐类的水解促进水的电离,弱酸弱碱的电离抑制水的电离。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源:2013届山东省济南世纪英华实验学校高三上学期期末考试化学试卷(带解析) 题型:填空题
(11分)已知N2O4 (g)  2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,
(1)现将1 mol N2O4 充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是________。
(2)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”、“不变”或“减小” )。反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·S-1。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填”正向”“不”或“逆向”)移动。
查看答案和解析>>
科目:高中化学 来源:2013届福建莆田一中高二下学期第一学段考试化学试卷(1)(解析版) 题型:选择题
下列措施或事实不能用勒沙特列原理解释的是( )
A.滴加酚酞的氨水中加入氯化铵固体后红色变浅
B. 棕红色的NO2加压后颜色先变深后变浅(已知: 2NO2 (g)  N2O4 (g))
N2O4 (g))
C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
D. 煅烧粉碎的硫铁矿利于SO2的生成
查看答案和解析>>
科目:高中化学 来源: 题型:
已知N2O4(g) ![]() 2NO2 (g),在25℃的平衡常数
2NO2 (g),在25℃的平衡常数![]() = 0.14。判断总压为101.325 kPa时下列体系中反应的方向。
= 0.14。判断总压为101.325 kPa时下列体系中反应的方向。
(1)N2O4与NO2含量为13(物质的量之比)的气体混合物;
(2)N2O4与NO2含量等于41的气体混合物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com