
分析 跟金属铝反应生成H2的溶液可能为酸溶液,也可能为碱溶液,当生成Al3+时,溶液为酸溶液,当生成AlO2-时,溶液为碱溶液,然后利用离子的共存来分析,并注意离子在水中的颜色.
解答 解:离子均为无色,所有离子均与无色透明溶液符合;铝既能与酸作用产生氢气,也能与碱作用产生氢气,
(1)溶液和铝粉反应后有Al3+生成,离子反应方程式为:2Al+6H+=2Al3++3H2↑,溶液显酸性,则HCO3-、OH-不存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-,根据溶液不显电性,一定存在阴离子,即溶液中肯定有Cl-,而Ag+可与Cl-生成沉淀,说明原溶液中也不存在Ag+,即溶液中一定含有大量的H+、Cl-,可能含Na+、Mg2+,一定不能含有:Ag+、OH-、HCO3-、NO3-,
故答案为:2Al+6H+=2Al3++3H2↑;H+、Cl-;Ag+、OH-、HCO3-、NO3-;
(2)溶液和铝粉反应后有AlO2-生成,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,溶液显碱性时,Mg2+、H+、Ag+、HCO3-不能存在,根据溶液不显电性,一定存在阳离子,即阳离子只有Na+,说明原溶液中的阴离子一定含OH-,可能含NO3-、Cl-,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Na+、OH-;Mg2+、H+、Ag+、HCO3-.
点评 本题考查常见离子的检验,为高频考点,把握溶液酸碱性判断、发生的离子反应、离子共存为解答的关键,侧重分析与应用能力的考查,题目难度中等.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-+Cl2═S↓+2Cl- | B. | S2-+2Br-+2Cl2═S↓+Br2+4Cl- | ||
| C. | 2S2-+2Br-+3Cl2═2S↓+Br2+6Cl- | D. | 3S2-+2Br-+4Cl2═3S↓+Br2+8Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
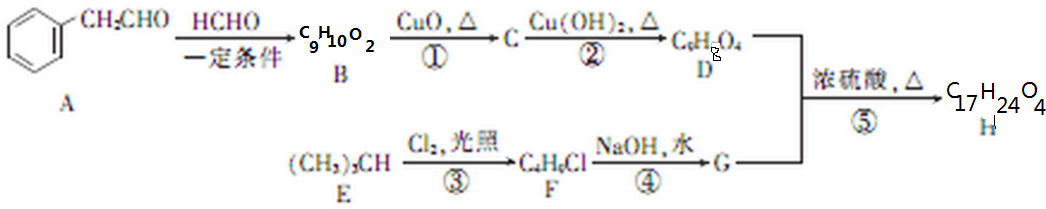
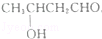
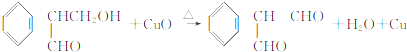
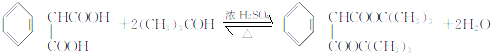
 (不考虑立体异构)?
(不考虑立体异构)?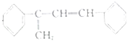 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
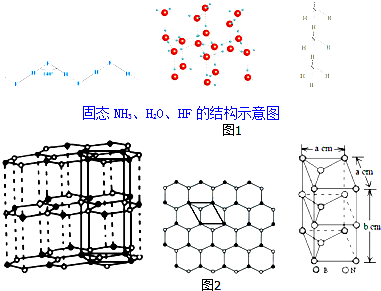
 .
.| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+O2═2H2O△H=-571.6KJ/mol | |
| B. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-142.9KJ/mol | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)═H2O (l)△H=-285.8KJ/mol | |
| D. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com