
【题目】(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡 向________(填“正”或“逆”)反应方向移动;溶液中![]() 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5 mol·L-1;
b.CH3COOH+NaHCO3===CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为________________。
②该温度下,将0.01 mol·L-1H2A溶液稀释到20倍后,溶液的pH=__________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气____________。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为___________________________。
【答案】(1) 逆,不变; (2) 中,碱,NH![]() ;
;
(3)①H2A===2H++A2-;②3; ③C;④c(NH![]() )>c(A2-)>c(H+)>c(OH-)。
)>c(A2-)>c(H+)>c(OH-)。
【解析】
试题分析:(1)CH3COOH![]() CH3COO-+H+,加入醋酸钠,增加c(CH3COO-),平衡向逆反应方向进行,此比值为醋酸的电离平衡常数,电离平衡常数只受温度影响,温度不变,电离平衡常数不变;(2)根据Kh=Kw/K,CH3COOH和NH3·H2O电离平衡常数相等,水解平衡常数相等,则c(H+)=c(OH-),溶液呈现中性,根据b信息,醋酸酸性强于碳酸,因此HCO3-的水解程度大于NH4+,c(OH-)>cH+),溶液显碱性,离子浓度大小顺序是c(NH4+)>c(HCO3-)>c(OH-)>c(H+),离子浓度最大的是NH4+;(3)①Kw=10-12,溶液显中性时的pH=6,Na2A的pH=6,溶液显中性,即H2A为强酸,完全电离H2A=2H++A2-;②0.01mol·L-1H2A中c(H+)=0.02mol·L-1,稀释20倍后,c(H+)=0.001mol·L-1,即pH=3;③盐酸和H2A的pH相同,c(H+)相同,因此产生氢气的体积相等,故选项C正确;④两者恰好完全反应,反应后溶质为(NH4)2A,NH4+水解,但水解程度微弱,溶液显酸性,即c(NH4+)>c(A2-)>c(H+)>cOH-)。
CH3COO-+H+,加入醋酸钠,增加c(CH3COO-),平衡向逆反应方向进行,此比值为醋酸的电离平衡常数,电离平衡常数只受温度影响,温度不变,电离平衡常数不变;(2)根据Kh=Kw/K,CH3COOH和NH3·H2O电离平衡常数相等,水解平衡常数相等,则c(H+)=c(OH-),溶液呈现中性,根据b信息,醋酸酸性强于碳酸,因此HCO3-的水解程度大于NH4+,c(OH-)>cH+),溶液显碱性,离子浓度大小顺序是c(NH4+)>c(HCO3-)>c(OH-)>c(H+),离子浓度最大的是NH4+;(3)①Kw=10-12,溶液显中性时的pH=6,Na2A的pH=6,溶液显中性,即H2A为强酸,完全电离H2A=2H++A2-;②0.01mol·L-1H2A中c(H+)=0.02mol·L-1,稀释20倍后,c(H+)=0.001mol·L-1,即pH=3;③盐酸和H2A的pH相同,c(H+)相同,因此产生氢气的体积相等,故选项C正确;④两者恰好完全反应,反应后溶质为(NH4)2A,NH4+水解,但水解程度微弱,溶液显酸性,即c(NH4+)>c(A2-)>c(H+)>cOH-)。


科目:高中化学 来源: 题型:
【题目】一定条件下,恒容的密闭容器中存在反应:2A(g)+B(s) ![]() 2C(g) △H<0。下列描述中能证明上述反应已达平衡状态的是
2C(g) △H<0。下列描述中能证明上述反应已达平衡状态的是
A.摩尔质量:A<C
B.容器中混合气体的密度不随时间而变化
C容器中的气体压强不随时间而变化
D.容器中A与C的物质的量之比等于1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B是短周期元素,两元素能形成B2A型离子化合物,B离子比A离子少一个电子层,已知A的原子序数为n,则B的原子序数为( )
A.n﹣5
B.n+3
C.n+13
D.n﹣13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是

A. 1molC和1molH2O反应生成1molCO和1molH2一定吸收131.3kJ的热量
B. 反应的热化学方程式可表示为C(s)+H2O(g)=CO(g)+H2(g) ΔH=(a-b)KJ/mol
C. 该反应过程反应物断键吸收的能量要小于生成物成键放出的能量
D. 加入适当的催化剂,可以加快正、逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,使2molN2和6molH2混合发生下列反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)当反应达到平衡时, N2和H2的转化率比是 。
(2)当达到平衡时,将c(N2)、c(H2)、c(NH3)同时减小一倍,平衡将向 移动(填“向左”、“向右”或“不”)。
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将向___________移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将___________移动(填“向 左”、“向右”或“不”)。达到新平衡后,容器内温度 (填“大于”、“小于”或“等于”)原来的2倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3)的原理如下图:

(1)二甲醚的合成反应:3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g) ΔH1
CH3OCH3(g)+CO2(g) ΔH1
①已知CO、H2与CH3OCH的燃烧热(ΔH)分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、(a、b、c均小于0),则ΔH1=________kJ·mol-1。
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能_______(填标号)。
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
ⅰ. CH4(g)+Fe3O4(s)![]() CO(g)+2H2(g)+3Fe(s)
CO(g)+2H2(g)+3Fe(s)
ⅱ. CH4(g)+4Fe3O4(s)![]() CO2(g)+2H2O(g)+12FeO(s)
CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如下图。

①随着压强的增大,反应ⅰ的平衡常数K值________(填“增大”、“减小”、 或“不变”)
②结合图像,分析H2O的体积分数变化的原因_________(用化学方程式表示)
(3)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g)+3FeO(s)![]() Fe3O4(s)+ CO (g) ΔH2
Fe3O4(s)+ CO (g) ΔH2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表:
温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①ΔH2_______0(填“>”或“<”)。
②若在150℃时进行上述转化,理论转化率ɑ(FeO)=___________。
③在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.体系的压强不变 B.CO2的物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2还原器温度设置在170℃的原因___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物C是一种合成药品的中间体,其合成路线为:
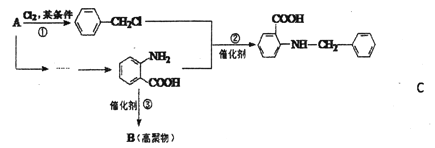
已知:
(1)写出![]() 中宮能团的名称_____________。
中宮能团的名称_____________。
(2)写出反应①的化学方程式_________________。
(3)反成②属于_______反应(填有机反应类型)。
(4)D是比![]() 多一个碳的同系物,则满足下列条件的D的间分异构体共有______种,写出一种满足条件且含4种不同氢原+的同分异构体的结构简式 __________。
多一个碳的同系物,则满足下列条件的D的间分异构体共有______种,写出一种满足条件且含4种不同氢原+的同分异构体的结构简式 __________。
①显弱碱性,易被氧化 ②分子内含有苯环 ③能发生水解反应
(5)请你设计由A合成B的合成路线。 __________
提示:①合成过程中无机试剂任选;②合成路线表示方法示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下,下列选项正确的是
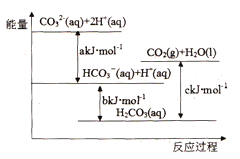
A. H2CO3(aq)=CO2(g)+H2O(l)为放热反应
B. CO32-(aq)+ H+(aq)=HCO3-(aq) △H=akJ/mol
C. HCO3-(aq)+H+(aq)= CO2(g)+H2O(l) △H=(c-b)kJ/mol
D. CO32-(aq)+ 2H+(aq)= CO2(g)+H2O(l) △H=(a+b-c)kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com